Фазовая диаграмма - равновесие
Cтраница 1
Фазовые диаграммы равновесия жидкость - твердая фаза могут быть двух типов: с образованием твердого раствора или эвтектической смеси. При охлаждении системы до температуры t образуется жидкая фаза А и равновесная твердая фаза В, обогащенная более высокоплавким компонентом - антраценом, однако получение чистого антрацена одноступенчатой кристаллизацией невозможно. [1]
Фазовые диаграммы равновесия жидкость - твердая фаза могут быть двух типов: с образованием твердого раствора или эвтектической смеси. При охлаждении системы до температуры t образуется жидкая фаза А и равновесная твердая фаза В, обогащенная более высокоплавким компонентом-антраценом, однако получение чистого антрацена одноступенчатой кристаллизацией невозможно. [2]
Построить фазовые диаграммы равновесия в координатах X, Y - z, Z для системы гептан - метилциклогексан - анилин при 25 С. [3]
Построить фазовые диаграммы равновесия в координатах X, Y - z, Z и X - Y для системы вода - уксусная кислота - изопропиловый эфир при 20 С, пользуясь данными о равновесных составах сосуществующих фаз [ в % ( масс.) ], приведенными в табл. 8.9. Соединительные линии на диаграмме X, Y - г, Z проводить не следует. [4]
Нарисуйте приближенную фазовую диаграмму равновесия твердое вещество-жидкость-пар для ртути. Правильно укажите наклоны каждой кривой, положение критической точки и по крайней мере приближенно-место расположения тройной точки относительно 298 К и давления 1 атм. Плотность жидкой ртути равна 13 6 г-см-3. К чему ближе молярный объем ртути в критической точке-к молярному объему паровой или жидкой фазы ртути при 298 К. [5]
 |
Фазовая диаграмма равновесия ( в объемы. % при 25 С н-гептан - толуол - N-метилпирролидон. [6] |
Рис - - 2.10. Фазовая диаграмма равновесия ( в объешь %) при 25 С н-гептан - толуол - N-метилпирролидон ( - 10 % Н20) при 25 РС. [7]
При таком методе работы фазовая диаграмма равновесия растворитель - неароматический углеводород - ароматический углеводород может быть закрытой. При использовании диметил-сульфоксида с содержанием до 10 % воды бинодальная кривая имеет закрытый характер ( см. рис. 2.22, стр. Промывкой экстракта бутаном можно вытеснить неароматические углеводороды и, отделив бутан, получить бензол высокой чистоты. [8]
Области устойчивости модификаций определяются фазовыми диаграммами равновесия. Метаста-бильные фазы - устойчивые в данных условиях состояния, не соответствующие значению абсолютного минимума свободной энергии. Образование метастабильных фаз возможно только при фазовых превращениях первого рода. Металлы и сплавы, в к-рых возможны полиморфные превращения, можно подвергать термической обработке. Так, нагрев железоуглеродистых и некоторых меди сплавов выше критических точек и последующее охлаждение со скоростью, подавляющей диффузию, позволяют зафиксировать модификации кристал. В метастабильном ( закаленном, переохлажденном) состоянии кристаллический материал может находиться до тех пор, пока не будет выведен из него каким-либо внешним воздействием. В таком состоянии при обычных условиях находятся алмаз, кубическая модификация нитрида бора ( боразон), три-димит, кристобалит - стабильные в области высоких температур. Под действием давления в точке превращения уменьшается объем, увеличивается тем самым плотность материала. [9]
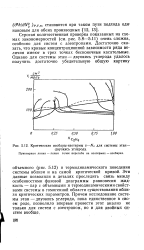 |
Критические изобары-изотермы и - Nt для системы этан - двуокись углерода. [10] |
Эти данные позволили в деталях проследить связь между особенностями фазовой диаграммы равновесия жидкость - пар с объемными и термодинамическими свойствами системы в гомогенной области существования вблизи критических параметров. [11]
Области устойчивости полиморфных модификаций и точки перехода между ними определяются фазовыми диаграммами равновесия, расчет к-рых основан на вычислении термодинамич. [12]
Этот метод не позволяет определить траектории хребтовых и лощинных линий на фазовой диаграмме паро-жид-костного равновесия, т.е. находить области непрерывной дистилляции. [13]
Этот коэффициент показывает отношение фактического парциального давления двуокиси углерода в воздухе к теоретическому, найденному по фазовой диаграмме равновесия паров над твердой СО2 при данной температуре и давлении. [14]
В табл. 35 приведены величины коэффициента k, показывающего отношение фактического парциального давления двуокиси углерода в воздухе к теоретическому, найденному по фазовой диаграмме равновесия паров над твердой СО2 при данной температуре и давлении. [15]
Страницы: 1 2