Фазовая диаграмма - вещество
Cтраница 1
 |
Диаграмма состоя - [ IMAGE ] Фазовые превращения. [1] |
Фазовая диаграмма вещества, построенная вр - К-координатах, характерна тем, что область равновесия двух фаз изображена не одной линией ( как в р - Т - координатах), а представляет собой соответствующие площади диаграммы, разделенные линиями, которые называются пограничными кривыми. На рис. 28 приведена фазовая диаграмма вещества в р - V -координатах. На диаграмме область / характеризует твердое состояние, область / / - жидкое состояние, а область / / / - газообразное состояние вещества. Область IV соответствует равновесному сосуществованию жидкой и газообразной фаз вещества. Массовая доля пара, обозначаемая через х, называется степенью сухости, а массовая доля жидкости, обозначаемая через у, называется степенью влажности. Область V характеризует твердую и газообразную фазы, область VI - твердую и жидкую фазу вещества. [2]
Вся фазовая диаграмма вещества, например, в координатах плотность - температура, может быть условно разделена на три области. [4]
На фазовой диаграмме однокомпонентного вещества ( рис. 11) ь соответствии с определениями критических параметров нанесены области жидкости и пара, причем оказывается, что критическая точка является началом условных координат новой области - области закритического состояния ( Р РК, t tK), в пределах которой вещество может быть только в одно-фазовом состоянии. [5]
Наибольшие проблемы при исследовании фазовой диаграммы вещества возникают при моделировании жидкой фазы и переходов жидкость - твердое тело и жидкость - газ. Однако именно решение задачи определения условий фазового перехода, а для смесей - фазовых равновесий представляет интерес как с научной, так и с практической точки зрения. [6]
Может оказаться также весьма плодотворным отмеченное в нашем докладе и высказанное в дискуссии соображение о наличии связи между фазовыми диаграммами вещества в трехмерном, двумерном и одномерном состояниях. [7]
Мы видим, что для последовательного теоретического анализа доступны лишь состояния с экстремально высокими давлениями и температурами, находящиеся на периферии фазовой диаграммы вещества. При больших плотностях плазма остается сильнонеидеальной благодаря межионному взаимодействию вплоть до вырождения ионов. [8]
Фазовая диаграмма вещества, построенная вр - К-координатах, характерна тем, что область равновесия двух фаз изображена не одной линией ( как в р - Т - координатах), а представляет собой соответствующие площади диаграммы, разделенные линиями, которые называются пограничными кривыми. На рис. 28 приведена фазовая диаграмма вещества в р - V -координатах. На диаграмме область / характеризует твердое состояние, область / / - жидкое состояние, а область / / / - газообразное состояние вещества. Область IV соответствует равновесному сосуществованию жидкой и газообразной фаз вещества. Массовая доля пара, обозначаемая через х, называется степенью сухости, а массовая доля жидкости, обозначаемая через у, называется степенью влажности. Область V характеризует твердую и газообразную фазы, область VI - твердую и жидкую фазу вещества. [9]
Такая структура системы обусловлена сложным характером фазовых диаграмм веществ, применяемых в химической технологии основного органического синтеза. [10]
Различные агрегатные состояния вещества определяются, прежде всего, температурой и давлением: если давление мало, температура достаточно высока, то вещество будет находиться в газообразном состоянии, при низкой температуре вещество будет твердым, при умеренных ( промежуточных) температурах - жидким. В соответствии с этим, для количественной характеристики агрегатных состояний вещества часто используется очень наглядная фазовая диаграмма вещества, которая показывает зависимость агрегатного состояния от давления и температуры. [11]
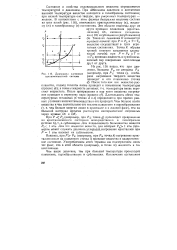 |
Диаграмма состояния однокомпонентной системы. [12] |
Состояние и свойства индивидуального вещества определяются температурой и давлением. При небольшом давлении и достаточно высокой температуре вещество находится в газообразном состоянии; при низкой температуре оно твердое, при умеренных температурах - жидкое. В соответствии с этим фазовая диаграмма вещества состоит из трех полей ( рис. 116), отвечающих кристаллическому ( к), жидкому ( ж) и газообразному ( г) состояниям. [13]
Использование ударных волн позволило получить давления конденсированного вещества до нескольких сотен тысяч мегапаскалей и провести при этом обширные термодинамические, оптические и электрофизические [2-6] исследования. Таким образом, были проведены физические измерения в части фазовой диаграммы вещества, недоступной ранее для традиционных методов плазменного эксперимента. [14]
Страницы: 1
