Метод - прямая потенциометрия
Cтраница 1
Метод прямой потенциометрии основан на точном измерении величины электродного потенциала и нахождении по уравнению Нернста активности потенциалопределяющего иона в растворе. Долгое время прямая потенциометрия находила ограниченное применение, в аналитической химии, а именно только для определения рН растворов. [1]
Метод прямой потенциометрии основан на точном измерении величины электродного потенциала и нахождении по уравнению Нернста активности потенциалопределяющего иона в растворе. Долгое время прямая потенциометрия находила ограниченное применение в аналитической химии, а именно только для определения рН растворов. [2]
Метод прямой потенциометрии обладает некоторыми важными достоинствами. В процессе измерения компоненты анализируемого раствора не разлагаются. Метод позволяет проводить определение из маленького объема, дает возможность работать с относительно разбавленными растворами. Полученные результаты легко регистрируются автоматически, что позволяет использовать прямую потенциометрию для контроля технологических процессов и биологических систем. [3]
Следует различать метод прямой потенциометрии и метод потенциомет-рического титрования. Во втором методе определяемое вещество титруют подходящим рабочим раствором, измеряя в процессе титрования потенциал какого-либо электрода. Этот метод относится к химическим методам анализа, так как он основан на проведении химической реакции в растворе. В ме оде же прямой потенциометрии химическую реакцию не проводят: измеряют потенциал электрода, погруженного в испытуемый раствор, и затем по соответствующему уравнению вычисляют концентрацию определяемых ионов. Наиболее распространенный метод прямой потенциометрии - определение рН раствором посредством стеклянного или какого-либо другого электрода. [4]
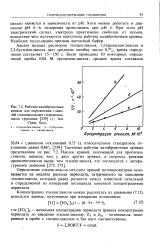 |
Рабочие калибровочные кривые для определения глико-лей с вицинальными гидроксиль-ными группами ( Am. Chem. Soc.. [5] |
Определение этиленгликоля методом прямой потенциометрии основывается на анализе расхода периодата, затраченного на окисление этиленгликоля, который равен разности между известной начальной и определяемой из измерений потенциала конечной концентрациями периодата. [6]
При определении концентрации методом прямой потенциометрии необходимо введение поправок из-за влияния мешающих ионов, находящихся в пробе. Присутствие этих ионов ограничивает точность метода вследствие смещения потенциала ион-селективного электрода. [7]
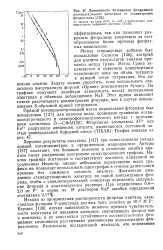 |
Зависимость потенциала фторидного ионоселективного электрода от концентрации фторид-иона [ 128J. [8] |
Хорошие результаты получены [137] при использовании метода прямой потенциометрии в органическом микроанализе. Авторы [137] полагают, что большое значение в снижении ошибки анализа имеет ежедневное построение градуировочного графика. Наклон графика постоянен и соответствует величине, найденной по уравнению Нернста, однако небольшое перемещение всего графика не позволяет использовать один график в течение длительного времени без снижения точности анализа. Достаточно ежедневно стандартизировать электрод по одной концентрации фторида, чтобы с удовлетворительной точностью определять содержание фторида в анализируемом растворе. [9]
Электрод указанного типа пригоден для определения этих витаминов методом прямой потенциометрии или потенциометрического титрования тетрафенилбората натрия. [10]
Мембранные электроды широко применяют для измерения активности ионов в растворе методом прямой потенциометрии, например для определения анионов СЮ, МОз, Г, Вг -, СГ, SCN -, катионных и анионных поверхностно-активных веществ ( ПАВ) и др. Для аналитической химии представляет интерес возможность определения ионов путем потенциоме-трического титрования по методам окисления - восстановления, осаждения, комнлексообразования. В этом случае нет необходимости пересчитывать активность на концентрацию, так как точку эквивалентности при титровании устанавливают путем наблюдения за изменением концентрации, а концентрация и активность при постоянной ионной силе раствора изменяются в одинаковой степени. [11]
Кальман и др. [219] исследовали также возможность определения гидрогалогенидов алкалоидов методом прямой потенциометрии с ион-селективными электродами как в отдельности, так и в смеси с другими веществами, однако ошибки анализа оказались значительно большими, чем при потенциометрическом титровании. Наилучшие результаты получены для 0 1 М нитрата калия, но и здесь нельзя избежать мешающего действия. Ошибки определения в основном отрицательные, что, вероятно, связано с неточностями в установлении коэффициентов активности. [12]
Поскольку погрешность вследствие неизвестности жидкостных диффузионных потенциалов легко может превысить 1 мВ, для получения правильных аналитических результатов методом прямой потенциометрии обычно требуется применение эмпирической калибровки или метода стандартных добавок. [13]
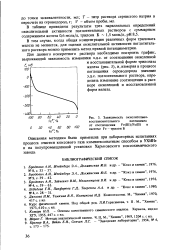 |
Зависимость окислительно-восстановительного потенциала от соотношения Fe ( IH / Fe ( H в системе Fe - трилон Б. [14] |
В том случае, когда общая концентрация различных форм трилоната железа не меняется, для оценки окислительной активности поглотительного раствора можно применить метод прямой потенциометрии. [15]
Страницы: 1 2