Метод - расчет - константа - равновесие
Cтраница 1
Метод расчета констант равновесия из данных о нормальных ред-окс-потенциалах применим также и к определению возможности реакции дисмутации. [1]
Метод расчета константы равновесия К был дан в исключительно важном исследовании Д. В. Алексеева, Новые основания химической механики, Изв. [2]
Метод расчета констант равновесия из данных о нормальных ред-окс-потенциалах применим также и к определению возможности реакции дисмутации. [3]
Предложен метод расчета константы равновесия процесса деметилировапия 2-ме-тил - 5-этилпиридина для различных температур по кинетичоким данным. Достигнуто удовлетворительное совпадение расчетных и экспериментальных данных по конверсии МЭП и выходу 3-этилпиридина. [4]
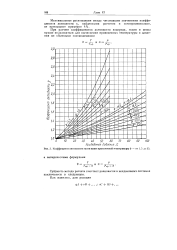 |
Коэффициент активности газов выше критической температуры Ф - от 3 5 до 35. [5] |
Сущность метода расчета констант равновесия в неидеальных системах заключается в следующем. [6]
В основе всех методов расчета констант равновесия химических реакций лежат общие термодинамические соотношения типа уравнений ( VII, 8) и ( VII, 18), а собственно статистическая часть расчета сводится к вычислению стандартных энтропии компонентов реакции при различных температурах и изменений тепловых эффектов реакций с температурой. [7]
Поскольку энтропии, которые в большинстве случаев определяются с помощью третьего закона термодинамики, входят в функции свободных энергий, метод расчета констант равновесия из данных ло энтальпиям реакций с использованием функций энергий Гиббса и наоборот называется методом расчета термодинамических свойств по третьему закону термодинамики. [8]
Поскольку энтропии, которые в большинстве случаев определяются с помощью третьего закона термодинамики, входят в функции свободных энергий, метод расчета констант равновесия из данных по энтальпиям реакций с использованием функций энергий Гиббса и наоборот называется методом расчета термодинамических свойств по третьему закону термодинамики. [9]
Величина AZ s для данного процесса может быть вычислена по правилу, аналогичному тому, которое было применено при вычислении тепловых эффектов ( гл. III, раздел 1); при комбинировании необходимо, чтобы все вещества во всех реакциях были при одинаковых Р и Т и в одинаковых агрегатных состояниях. Это дает еще один метод расчета константы равновесия. [10]
Страницы: 1