Кинетический метод - применение - меченый атом
Cтраница 1
Кинетический метод применения меченых атомов [1] использован в настоящей работе для выяснения вопроса о путях превращения ацетильного радикала при окислении различных углеводородов. [1]
Сущность кинетического метода применения меченых атомов к изучению механизма химических реакций состоит в том, что, добавляя в реагирующую систему в начальный или какой-либо другой момент времени то пли иное вещество, меченное соответствующим изотопом, можно, посредством измерения кинетики изменения концентрации и удельной активности этого вещества 4, как и веществ, являющихся предполагаемыми продуктами химического превращения добавляемого вещества, решить вопрос о том, какова действительная последовательность химического превращения веществ в данной реакции и какова скорость превращения исследуемых веществ в различные моменты времени по ходу реакции. [2]
Если процесс окисления метана протекает по механизму ( 3), то кинетический метод применения меченых атомов позволит выяснить, какая доля процесса идет через спирт и какая - через формальдегид. [3]
К сожалению, в этом разделе недостаточно рассмотрены возможности эффективного использования в кинетических исследованиях спектроскопического и масс-спектроскопического методов, а также кинетического метода применения меченых атомов, методов хемилюминесценции, электронного парамагнитного резонанса ( ЭПР), раздельного калориметрирования при гомогенно-гетерогенных процессах. Эти методы успешно применяются и получили значительное развитие в СССР. С их помощью получено много сведений о детальном механизме сложных, в частности цепных, реакций. [4]
К сожалению, в этом разделе недостаточно рассмотрены возможности эффективного использования в кинетических исследованиях спектроскопического и масс-спектроскопического методов, а также кинетического метода применения меченых атомов, методов хемилюминесценции, электронного парамагнитного резонанса ( ЭПР), раздельного калориметрирования при гомогенно-гетерогенных процессам. Эти методы успешно применяются и получили значительное развитие в СССР. С их помощью получено много сведений о детальном механизме сложных, в частности цепных, реакций. [5]
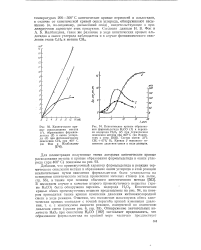
Добавим, что промежуточный характер формальдегида в реакции термического окисления метана и образование окиси углерода в этой реакции исключительно путем окисления формальдегида были установлены на основании кинетического метода применения меченых атомов ( см. выше, стр. Кинетические кривые обоих промежуточных веществ представлены на рис. 94, на котором приводится также кривая изменения давления метанокислородной смеси в ходе реакции. [7]
Таким образом, в настоящее время нет достаточных экспериментальных данных, на основе которых можно было бы однозначно решить, по какому из этих двух путей ( 2) или ( 3) на самом деле протекает реакция окисления метана. Кинетический метод применения меченых атомов однозначно ответит на этот вопрос. [8]
Вопрос о стадийном механизме сложных каталитических реакций представляет первостепенный интерес для катализа вообще и для каталитической кинетики. В этом отношении кинетический метод применения меченых атомов открывает новые возможности, так как он позволяет определять скорость накопления и расходования отдельных продуктов [1 ], а также устанавливать генетические связи между ними. [9]
Исследование распределения данного изотопа в продуктах реакции и в промежуточных веществах при осуществлении реакции в системах, содержащих вещества, меченные этим изотопом, позволяет решить такие важные вопросы механизма химической реакции, как вопрос о том, протекает ли реакция в изолированной молекуле или в молекулярном комплексе, разрывом каких связей обусловлены те внутри - или междумолекулярные перегруппировки, которые лежат в основе данной реакции, какие вещества являются предшественниками того или иного возникающего в ходе реакции вещества. Для решения последнего вопроса большое значение имеет кинетический метод применения меченых атомов, разработанный М. Б. Нейманом с сотрудниками [210] применительно к изучению механизма сложных химических реакций. [10]
Лишь в последние годы в Институте химической физики АН СССР М. Б. Нейман [33] разработал кинетический метод применения меченых атомов для исследования механизма сложных реакций, позволивший экспериментально определить скорости образования ( wj) и расходования ( и2) промежуточных продуктов. [11]
Исследование распределения данного изотопа в продуктах реакции и в промежуточных веществах при осуществлении реакции в системах, содержащих вещества, меченные этим изотопом, позволяет решить ряд важных вопросов механизма химической реакции. В частности, это вопрос о том, протекает ли реакция в изолированной молекуле или в молекулярном комплексе, разрывом каких связей обусловлены те внутри - или межмолекулярные перегруппировки, которые лежат в основе реакции, какие соединения являются предшественниками того или иного возникающего в ходе реакции вещества. Для решения последнего вопроса большое значение имеет кинетический метод применения меченых атомов, разработанный Нейманом с сотрудниками [248, 250] применительно к изучению механизма сложных химических реакций ( см. [249]), представляющего совокупность большого числа стадий, в которых исходные вещества превращаются в продукты реакции. Как было показано Нейманом с сотрудниками, кинетический метод позволяет не только установить последовательность-превращений одних веществ в другие, но и измерить скорости образования и расходования в ходе реакции различных участвующих в ней веществ. [12]
Инициирующее действие поверхностей играет в кинетике цепных реакций очень большую роль. Возможность рождения радикалов на поверхности с последующим вылетом их в объем впервые весьма наглядно была продемонстрирована опытами М. В. Полякова [217], который показал, что активированный палладием водород обладает всеми свойствами атомарного водорода и, в частности, способен инициировать цепную реакцию окисления. Точно так же М. Б. Нейман и Е. И. Попов [208] при помощи кинетического метода применения меченых атомов показали, что активные центры, образующиеся в результате гетерогенной реакции, идущей на серебряном катализаторе, способны вызывать в объеме газа цепную гомогенную реакцию при температуре, более низкой, чем температура катализатора. [13]
Страницы: 1