Надперекись
Cтраница 1
Надперекиси отличаются от перекисей большей легкостью выделения кислорода и большей реакционной способностью. [1]
Надперекиси 238 Направленность связи 53 Насыщаемость 53 Натр едкий 301 Натрий 296 и ел. Натяжение поверхностное 84 Нашатырь 255 Нейтрон 21 Некрасов Б. В. ПО Нернст В. [2]
Надперекиси МеО2 - желтые кристаллические вещества тетрагональный сингонии, при нагревании выше 180 - 200 обратимо изменяющие цвет на оранжевый. Плавятся надперекиси при 412 ( RbO2) и 432 ( CsO2) [31], однако до плавления начинают разлагаться. [3]
Надперекиси отличаются от соответствующих перекисей легкостью выделения кислорода при введении в воду с температурой льда. В аналогичных условиях в отсутствие катализатора перекиси не разлагаются. Надперекись натрия, по-видимому, устойчива лишь при низких температурах. [4]
Надперекись - нестойкое образование и в отсутствие веществ, с которыми она могла бы реагировать, спонтанно разлагается, выделяя молекулярный кислород. [5]
Надперекиси МеО2 - желтые кристаллические вещества тетрагональный сингонии, при нагревании выше 180 - 200 обратимо изменяющие цвет на оранжевый. Плавятся надперекиси при 412 ( RbO2) и432 ( CsO2) [31], однако до плавления начинают разлагаться. [6]
Надперекиси щелочноземельных металлов до сих пор не удалось выделить в чистом виде, так как они всегда получаются в смеси с обычными перекисями. Эти смеси ( с приблизительным содержанием 8 - 9 % надперекисей) представляют собой порошки желто-зеленого цвета, устойчивые к умеренному нагреванию, но при более высоких температурах разлагающиеся с образованием перекисей. При еще более сильном нагревании разлагаются и сами перекиси. [7]
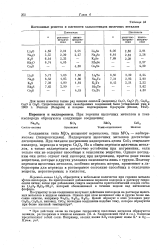 |
Постоянные решеток и плотности халькогенидов щелочных металлов. [8] |
Надперекиси щелочных металлов достаточно легкоплавки. Но в общем перекиси щелочных металлов, а также надперекиси достаточно устойчивы при нагревании, если только они не содержат способные к окислению вещества. Однако последним они легко отдают свой кислород при нагревании, притом даже таким веществам, которые в других условиях окисляются лишь с трудом. Поэтому перекиси щелочных металлов, особенно перекись натрия, применяют в лаборатории для перевода в растворимое состояние способных к окислению веществ, нерастворимых в кислотах. [9]
Надперекиси щелочноземельных металлов до сих пор не удалось выделить в чистом виде, так как они всегда получаются в смеси с обычными перекисями. [10]
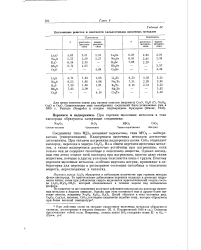 |
Постоянные решеток и плотности халькогенидов щелочных металлов. [11] |
Надперекиси щелочных металлов достаточно легкоплавки. Нов общем перекиси щелочных металлов, а также надперекиси достаточно устойчивы при нагревании, если только они не содержат способные к окислению вещества. Однако последним они легко отдают свой кислород при нагревании, притом даже таким веществам, которые в других условиях окисляются лишь с трудом. Поэтому перекиси щелочных металлов, особенно перекись натрия, применяют в лаборатории для перевода в растворимое состояние способных к окислению веществ, нерастворимых в кислотах. [12]
Надперекиси щелочноземельных металлов до сих пор не удалось выделить в чистом виде, так как они всегда получаются в смеси с обычными перекисями. [13]
Надперекиси щелочноземельных металлов Mg, Zn и Cd присутствуют лишь в очень небольших концентрациях в виде твердых растворов в соответствующих перекисях. Из приведенных данных очевидно, что существует прямая зависимость между электроположительностью рассматриваемого металла и устойчивостью его надперекиси. [14]
Ранее надперекиси щелочных металлов М 02 рассматривали как тетраокиси MaOi - Однако Касаточкин ( 1936) и Клемм ( Klemm, 1939) установили рентгенометрически, что они имеют такую же структуру, как и перекиси щелочноземельных металлов типа Ва02 ( см. стр. [15]
Страницы: 1 2 3 4