Сернокислое окисное железо
Cтраница 1
Сернокислое окисное железо является более эффективным реагентом по сравнению с сернокислым закисным железом в связи с тем, что степень гидролиза солей окиси железа выше, чем солей закиси железа, и вследствие этого процесс хлопье-образования проходит интенсивнее. [2]
Сернокислое окисное железо Fe2 ( SO4) 3 - 10Н2Ов качестве коагулянта применяется редко. Его получают обработкой Fe2O3 серной кислотой. Технический продукт содержит до 40 % нерастворимой илистой массы. [3]
Сернокислое окисное железо производят путем обработки окиси железа серной кислотой. [4]
 |
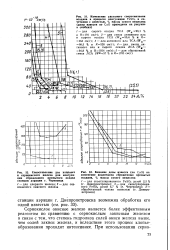
Схема установки для получения железного коагулянта контактированием хлорной воды с железной стружкой. [5] |
Сернокислое окисное железо Fe2 ( S04) 3 9H20 в качестве коагулянта применяется сравнительно редко. Получают его обработкой Fe203 серной кислотой. В нашей стране не имеется промышленного способа производства сульфата ( окисного) железа. Железный купорос и серная кислота являются отходами производства на многих промышленных предприятиях. [6]
Гипс и сернокислое окисное железо вводят до 1 %, поверхностно-активные вещества - до 0 3 % от массы цемента. [7]
В растворе сернокислого окисного железа было осаждено железо в виде гидрата окиси Fe ( OH) 3.1 Вес прокаленного осадка Fe2O3 оказался равным 0 3288 г. Написать уравнения реакций и вычислить: а) содержание Fe в растворе и б) содержание Fe SOJs в растворе. [8]
Удельный расход сернокислого окисного железа равен 7 - 25 мг на 1 мг удаленной кремнекислоты. [9]
 |
Схема типового реактиватора. [10] |
В качестве реагентов применяют сернокислое окисное железо и сернокислый алюминий. Иногда в целях ускорения процесса коагуляции и регулирования рН добавляют известь. Реагенты дозируют в сухом виде, затем растворяют в небольшом количестве воды и в виде раствора подают в смеситель реактиватора. [11]
В результате всестороннего изучения свойств сернокислого окисного железа установлено [53] влияние концентрации раствора реагента на процесс очистки, связанное с изменением коагулирующей способности гидроокиси железа в момент ее выделения в бикарбонатной среде. [12]
В целях упрощения анализа в реакционную смесь был введен раствор сернокислого окисного железа. Выделяющаяся по реакциям ( 1) - ( 5) медь растворяется, восстанавливая ионы Fe3 до Fe2; последние оттитро-вывают раствором двухромовокислого калия. Таким образом была исключена операция отфильтровывания осадка меди. [13]
Добавку извести в осадок следует предусматривать после введения клорного или сернокислого окисного железа. [14]
Добавку извести в осадок следует предусматривать после введения хлорного или сернокислого окисного железа. [15]
Страницы: 1 2 3 4