Наклон - кривая - плавление
Cтраница 2
Схематическая диаграмма состояний для вещества, имеющего три фазы - твердую, жидкую и газообразную - показана на рис. 10.5. Наклон кривой плавления АВ изображен для случая, когда плавление сопровождается уменьшением объема, как у льда. В отличие от кривой равновесия пара и жидкости Л / С, оканчивающейся при критической температуре в точке / С, кривая плавления АВ продолжается неограниченно. Кривая равновесия твердого тела с газом уходит в начало координат. Действительно, по законам классической механики при стремлении температуры к абсолютному нулю тепловое движение прекращается. Неподвижные атомы занимают такое расположение, при котором потенциальная энергия взаимодействия минимальна. Это расположение представляет собой регулярную пространственную решетку. Поэтому при абсолютном нуле температуры любое вещество с точки зрения классической механики должно быть кристаллическим. [16]
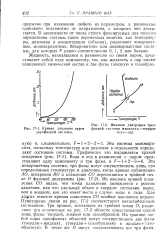 |
Кривая давления паров двухфазной системы.| Фазовая диаграмма трехфазной системы жидкость-твердое тело-пар. [17] |
Эта система моноварианта, поскольку температура или давление в отдельности определяют состояние системы. Из наклона кривой плавления СО видно, что точка плавления понижается с ростом давления, или что удельный объем в твердом состоянии выше, чем в жидком, как это имеет место в случае воды и льда. Для других веществ кривая плавления СО вообще наклонена вправо. Пунктирные линии на рис. 17 - 2 соответствуют метастабильным состояниям. Три кривые, исходящие из тройной точки О, разделяют три отмеченные на рис. 17 - 2 области существования одной лишь фазы: твердой, жидкой или газообразной. В точке же О могут сосуществовать все три фазы. [18]
В случае воды, висмута, чугуна и галлия мольный объем жидкой фазы меньше мольного объема твердой фазы, и величина ( Vz-Vi) оказывается отрицательной. Графически это соответствует наклону кривой плавления влево. [19]
В случае воды, висмута, чугуна мольный объем жидкой фазы меньше мольного объема твердой фазы, и величина ( У2 - V) оказывается отрицательной. Графически это соответствует наклону кривой плавления влево. [20]
В случае воды, висмута, чугуна и галлия мольный объем жидкой фазы меньше мольного объема твердой фазы, и величина ( Vz-Vi) оказывается отрицательной. Графически это соответствует наклону кривой плавления влево. [21]
 |
Кривые фазового равновесия воды.| Кривая фазового равновесия кристаллической и жидкой фаз рубидия.| Кривые фазового равновесия в области тройной точки. [22] |
Тупой угол в обычных условиях наблюдается только у некоторых веществ - воды, висмута, чугуна, таллия, германия. Эти вещества считают аномальными. При низких температурах ( Т - 0) угол наклона кривой плавления оказывается острым, приближающимся к нулю. [23]
На рис. 6.2 показаны области, соответствующие трем различньш кристаллическим модификациям льда. Всего их известно для Н2О шесть - три остальные могут существовать только при давлениях выше 2 - Ю8 Па. Перестройка кристаллической структуры льда при высоких давлениях ( переход лед I - лед II) приводит в точке В к изменению наклона кривой плавления ОБЕ. Это свидетельствует о том, что образование льда II из жидкой воды сопровождается уже не увеличением, а уменьшением объема, которое характерно для большинства веществ при всех давлениях. [24]
На рис. 6.2 показаны области, соответствующие трем различным кристаллическим модификациям льда. Всего их известно для Н2О шесть - три остальные могут существовать только при давлениях выше 2 - Ю8 Па. Перестройка кристаллической структуры льда при высоких давлениях ( переход лед I - лед II) приводит в точке В к изменению наклона кривой плавления ОБЕ. Это свидетельствует о том, что образование льда II из жидкой воды сопровождается уже не увеличением, а уменьшением объема, которое характерно для большинства веществ при всех давлениях. [25]
Во-вторых, наклон кривой плавления на р - Т - диаграмме может быть разным, в отличие от кривой кипения, где давление всегда возрастает с увеличением температуры. Если при плавлении объем вещества увеличивается, то кривая плавления наклонена в ту же сторону, что и кривая кипения. Напомним, что при испарении объем всегда возрастает. Наклон кривой плавления будет противоположным, если при плавлении объем уменьшается, как это происходит, например, при таянии льда и плавлении чугуна. [26]
Во-вторых, наклон кривой плавления на р - Т - диаграм-ме может быть разным, в отличие от кривой кипения, где давление всегда возрастает с увеличением температуры. Если при плавлении объем вещества увеличивается, то кривая плавления наклонена в ту же сторону, что и кривая кипения. Напомним, что при испарении объем всегда возрастает. Наклон кривой плавления будет противоположным, если при плавлении объем уменьшается, как это происходит, например, при таянии льда. [27]
Из анализа кривых охлаждения калориметра, заполненного гелием под повышенным давлением, авторы установили смещение Х - точки с давлением в сторону низких температур. Интересно, что это именно та область, где наклон кривой плавления уменьшается и зависимость от температуры исчезает. [28]
Из анализа кривых охлаждения калориметра, заполненного гелием под повышенным давлением, авторы ус / га попили смещение Х - точки с давлением в сторону низких температур. К и давлению с: оло 30 спим. Интересно, что это именно та область, где наклон кривой плавления уменьшается и зависимость от температуры исчезает. [29]
При температуре Т, намного большей Ти, когда энергия теплового движения превышает энергию кулоновского взаимодействия составляющих плазму ионов и электронов, плазма по своим свойствам близка к свойствам газа и может рассматриваться как смесь ионного и электронного газов. С уменьшением температуры или с повышением плотности роль кулоновского взаимодействия возрастает, и плазма по своим свойствам приближается к жидкости. Жидко-подобная плазма отвечает состояниям, соответствующим зонам, расположенным вблизи участка A MN кривой фазового равновесия OAA MN. Снижая температуру или изменяя давление ( повышая его в области, расположенной ниже точки М, и уменьшая его в области, расположенной выше этой точки), можно вызвать фазовый переход из плазменного состояния в кристаллическое, так как в таких условиях энергетически более выгодным по сравнению с плазмой оказывается упорядоченное кристаллическое состояние. Наличие точки экстремума М на кривой фазового равновесия ( кривой плавления) - одной или нескольких - связано с тем, что при достаточно больших давлениях плотность вещества в жидком, т.е. жидкоподоб-ном плазменном состоянии может оказаться вследствие плотного расположения молекул меньше, чем в кристаллическом состоянии; изменение знака разности плотностей приводит к изменению угла наклона кривой плавления. [30]
Страницы: 1 2 3