Наклон - тафелевская прямая
Cтраница 1
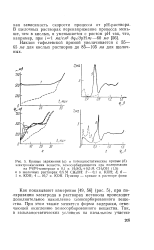 |
Кривые заряжения ( а и потенциостатические кривые ( б электроокисления веществ, хемосорбирующихся при поляризации. [1] |
Наклон тафелевской прямой увеличивается с 55 - 65 мв для кислых растворов до 85 - 105 мв для щелочных. [2]
Наклон тафелевской прямой увеличивается с - - 55 - 65 мв в кислых растворах до 85 - 105 мв в щелочных. [3]
По наклону тафелевской прямой легко определить коэффициент переноса а, а затем, учитывая связь константы а с 1ш0, найти ток обмена. [4]
По наклону тафелевской прямой легко определить коэффициент переноса а, а затем, учитывая связь константы а с In / 0, найти ток обмена. При выделении водорода на ртути в растворах НС1 было найдено а - 1 41 и b 0 116 в. [5]
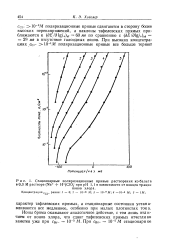 |
Стационарные поляризационные кривые растворения кобальта в 0 3 М растворе ( Na Н С1О. прирН 1 1 в зависимости от концен грации. [6] |
И поляризационные кривые сдвигаются в сторону более высоких перенапряжений, а наклоны тафелевских прямых приближаются к ( дЕ Id lg /) Si 60 мв по сравнению с ( дЕ ld gj) st 29 мв в отсутствие галоидных ионов. [7]
В табл. V.9 приведены кажущиеся коэффициенты переноса аг катодного процесса одноэлектронного восстановления адсорбированных комплексов Сг ( III), рассчитанные из наклона тафелевских прямых, полученных при Г const. Указанные коэффициенты переноса имеют более простой физический смысл, чем коэффициенты переноса, рассчитываемые из наклона тафелевских кривых, получаемых при постоянной объемной концентрации участвующих в реакции комплексов, когда поверхностная концентрация последних зависит от потенциала электрода. [8]
Согласно этому сила тока коррозионного элемента, работающего без диффузионных ограничений, достигает наибольшей величины, когда доля анодной зоны равна отношению коэффициента наклона тафелев-ской прямой для катодного процесса к сумме коэффициентов наклона тафелевских прямых анодного и катодного процессов. При этом совершенно безразлично, идет ли речь об электрохимической коррозии одного и того же металла в различных растворах, или же взята модель коррозионного элемента из двух разнородных металлов в одном растворе. [9]
В химической кинетике не имеется другого примера, где бы кинетическая закономерность соблюдалась в столь широком диапазоне скоростей. По наклону тафелевской прямой легко найти коэффициент переноса а, а затем, учитывая связь константы а с In i 0, определить ток обмена. При выделении водорода на ртути в растворах НС1 было найдено а1 41 и 60 116 В. [10]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож па платину. Данные опыта ( токи обмена и наклон тафелевских прямых) указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. [11]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Данные опыта ( токи обмена и наклон тафелевских прямых) указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. [12]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Опытные данные по величинам токов обмена и наклону тафелевских прямых указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. Кобозев и Монбланова ( 1935) доказали медленное протекание стадии рекомбинации на электродах из палладия. При наложении катодного тока на поляризационную сторону мембраны и смещении ее потенциала в отрицательном направлении выделение водорода вначале происходит только на поляризационной стороне, а затем и на диффузионной. [13]
Палладий по своему поведению при электрохимическом выделении водорода во многом похож на платину. Опытные данные по величинам токов обмена и наклону тафелевских прямых указывают на заторможенность рекомбинации как на вероятную причину водородного перенапряжения. Кобозев и Монбланова ( 1935) доказали возможность замедленного протекания стадии рекомбинации на электродах из палладия. При наложении катодного тока на поляризационную сторону мембраны и смещении ее потенциала в отрицательном направлении выделение водорода вначале происходит только на поляризационной стороне, а затем и на диффузионной. [14]
Тафелевская зависимость нарушается также за счет изменения степени заполнения поверхности катода атомами водорода, как это видно из кинетическорого уравнения процесса Гейровского. Если степень заполнения возрастает вместе с плотностью тока, то это также приводит к кажущемуся увеличению наклона тафелевской прямой. [15]
Страницы: 1 2