Накопление - перекись - водород
Cтраница 1
Накопление перекиси водорода в пленке приводит вследствие обратимости системы Оа - Н202 к уменьшению тока. Однако такое уменьшение тока вызывает снижение омического падения потенциала электрода вдоль пленки, в результате чего в процесс ионизации кислорода включаются новые, более удаленные участки поверхности электрода под пленкой, что приводит к возрастанию тока, В итоге суммарный ток ионизации остается почти таким же. Происходит расширение зоны реакции и уменьшение локальной плотности тока. [1]
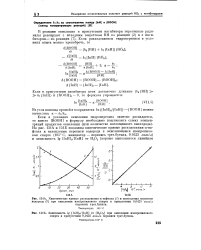 |
А. Кинетические кривые расходования а-нафтола ( 1 и накопления перекиси водорода ( 2 при окислении изопропилового спирта в присутствии 0 0425 молъ / л. [2] |
На рис. 151А и 151Б показаны кинетические кривые расходования а-на-фтола и накопления перекиси водорода в окисляющемся изопропило-вом спирте ( 105 С, инициатор - перекись трет. [3]
Как показали экспериментальные данные, скорость реакции окисления формальдегида увеличивается по мере накопления перекиси водорода и даже на значительных глубинах превращения исходных компонентов превышает начальное значение. [4]
Эта реакция играет существенную роль в организме в связи с тем, что накопление перекиси водорода оказывает вредное влияние на развитие клетки. [5]
Высказанное положение о первичности органической гидроперекиси находится как будто в противоречии с кинетикой накопления перекиси водорода и органической гидроперекиси, поскольку первой в реакционной смеси обнаруживается перекись водорода и только через некоторое время - органическая гидроперекись. Однако это противоречие является кажущимся. [6]
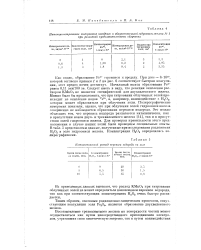 |
Каталитический распад перекиси водорода на золе. [7] |
Из приведенных данных вытекает, что расход КМп04 при титровании облученных золей не может определяться накоплением перекиси водорода, так как при соответствующих концентрациях Н202 очень быстро распадается. [8]
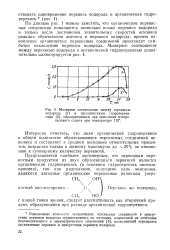 |
Молярное соотношение между перекисью водорода ( / и органическими гидроперекисями ( 2, образующимися при окислении изопро-пилового спирта при температуре 115. [9] |
По данным рис. 1 можно заметить, что органические перекис-ные соединения появляются несколько позже перекиси водорода и только после достижения значительных скоростей основной реакции образования ацетона и перекиси водорода; причем накопление органических перекисных соединений происходит сим-батно накоплению перекиси водорода. [10]
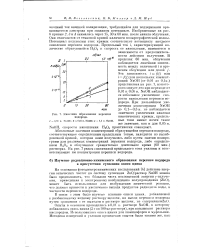 |
Кинетика образования перекиси водорода. [11] |
NaOH наблюдается небольшое увеличение скорости накопления перекиси водорода. NaOH, скорости накопления Н202 практически совпадают. [12]
Применяют также более концентрированные растворы. При работе следует соблюдать меры предосторожности, избегая накопления перекиси водорода в реакционной смеси. [13]
Задача каталитического разложения перекиси водорода, и таким образом устранения ее, осуществляется в биологических системах ферментом, называемым каталазой. Этот фермент, по-видимому, встречается во всех животных и растениях ( за исключением некоторых микроорганизмов), и одной из целей, которым он служит, является предотвращение возможности накопления перекиси водорода в токсических концентрациях. Каталаза исключительно эффективна в этом процессе; она активна при очень низких концентрациях перекиси водорода и способна осуществлять разложение со скоростью, значительно превышающей скорость для большинства других известных катализаторов. [14]
Ход кривой свидетельствует о том, что стабилизаторы резко повышают стабильность перекиси водорода в процессе ее образования. Благодаря этому выход перекиси водорода в интервале температур 100 - 120 соответствует почти количественному. Наиболее благоприятной представляется температура 115 - 120, при которой достигаются удовлетворительная ( до - 10 - 12 кг / м3 - ч) скорость накопления перекиси водорода и высокий выход последней, близкий к количественному. [15]
Страницы: 1 2