Кинетическое кривое накопление - продукт - реакция
Cтраница 1
 |
Зависимость логарифма скорости общего окисления тиоэфиров ( / и образования сульфоксидов ( / / в присутствии аце-тилацетоната ванадила от индуктивных постоянных уравнения Тафта. [1] |
Кинетические кривые накопления продуктов реакции имеют S-об-разный вид. Результаты опытов по окислению дибутилсульфида в присутствии ацетилацетоната ванадила удовлетворительно описываются уравнением, справедливым для автокаталитических реакций. Скорость реакции не зависит от концентрации кислорода и увеличивается с повышением концентрации тиоэфира. [2]
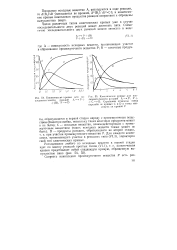
На рис. 1 показаны кинетические кривые накопления продуктов реакции гидрирования 1.2 - эпоксипентана на катализаторе ПУ. [3]
В заключение следует отметить, что характер кинетических кривых накопления продуктов реакции и ход процесса в целом может несколько меняться по сравнению с показанным на рис. 2 в случае наличия в окисляемом спирте различных примесей, что имеет место при переходе на техническое сырье. Так, например, ионы тяжелых металлов ускоряют распад перекисных соединений и тем самым способствуют развитию реакции до больших глубин. Это выражается иногда в снижении выхода перекисных соединений и более быстром накоплении таких молекулярных продуктов, как ацетон и уксусная кислота. [4]
Точно так же этот вопрос не может быть решен и путем анализа кинетических кривых накопления продуктов реакции. [5]
Поскольку исходные вещества А; расходуются в ходе реакции, то dCQjMdt уменьшается во времени, d2 [ By - ] / d / 20, и кинетические кривые накопления продуктов реакции возрастают и обращены выпуклостью вверх. [7]
Предположим, мы изучаем реакцию типа А Б и в реакционной смеси обнаружили присутствие двух продуктов - веществ В и Г, Прежде всего необходимо выяснить, параллельно или последовательно они образовались. Для этого нужно проанализировать кинетические кривые накопления продуктов реакции. Однако характерные признаки последовательных реакций - S-образный характер кинетической кривой накопления продукта и экстремальный характер кривой изменения концентрации промежуточного продукта г-не всегда проявляются настолько отчетливо, чтобы можно было сделать безошибочный вывод. Выше уже говорилось, что реакционная способность промежуточного продукта оказывает сильное влияние на форму кинетических кривых. [8]
 |
Молярные объемы продуктов окисления циклогексана. [9] |
Так как молекулярный объем продуктов окисления несколько отличается от молекулярного объема циклогексана, то накопление продуктов реакции сопровождается изменением объема жидкой фазы. Если такое изменение значительно, то-его необходимо учитывать при построении кинетических кривых накопления продуктов реакции. [10]
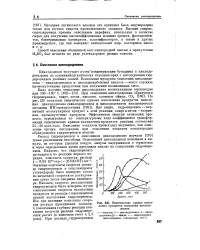 |
Кинетические кривые накопления продуктов окисления циклододекана. [11] |
Как видно, гидроперекись - первичный молекулярный продукт в этой реакции, спирт и кетон-вторичные, промежуточные продукты. Эффективная энергия активации процесса, определенная по температурному ходу коэффициента трансформации кинетических кривых накопления продуктов реакции, составляет 24 - 26 ккал / молъ. Окисление воздухом происходит медленнее, чем окисление чистым кислородом; при окислении воздухом концентрация образующейся гидроперекиси меньше. [12]
Поскольку [ АЛ всегда положительны, то d [ Bt ] / dt 0 и кинетические кривые продуктов реакции идут вверх. Исходные вещества [ Аг ] расходуются в ходе реакции. B ] ] / dtz 0, и кинетические кривые накопления продуктов реакции обращены выпуклостью вверх. [13]
Практически этот кинетический прием осуществлялся следующим образом. Таким образом, процесс окисления не имел места, и определяемые в смеси дополнительные количества спиртов и кетонов образовывались лишь за счет распада гидроперекисей. В соответствии с этим на кинетических кривых накопления продуктов реакции ( рис. 6) в момент разрушения перекиси ( этот момент на рис. 6отмечен стрелкой) наблюдается резкий спад концентрации перекиси и быстрое увеличение концентрации спиртов и кетонов. [14]
Страницы: 1