Наличие - диссоциация
Cтраница 1
Наличие диссоциации приводит к снижению заселенностей верхних колебательных уровней, что вызывает замедление диссоциации по сравнению с равновесными условиями тем большее, чем выше температура и абсолютная скорость диссоциации. При высоких температурах могут обедняться и заселенности нижних колебательных уровней, что приводит к отличию эффективной колебательной температуры от температуры газа. [1]
При наличии сильной диссоциации для равновесных концентраций можно вывести зависимости, которые обладают более постоянным характером, чем коэффициент распределения. [2]
Теоретическая температура горения при наличии диссоциации СО2 и Н20 снижается, как это видно из формулы ( см. стр. [3]
Для ртутной интоксикации характерным является наличие диссоциации в порогах восприятия различных ольфактивных веществ, причем резче всего и наиболее рано снижаются пороги восприятия розмарина, обладающего по преимуществу симпа-тикотропным эффектом. [4]
Как известно из курса общей химии, наличие диссоциации электролитов в растворах проявляется не только в способности последних проводить ток, но также в отступлении от законов Вант-Гоффа и Рауля, касающихся осмотического давления и понижения точки замерзания или повышения точки кипения растворов. [5]
Джонсон и Кольбарн [29, 64] не только однозначно доказали наличие диссоциации, но и определили энтальпию и энтропию диссоциации. В работе [29] Джонсон и Кольбарн предлагают для энтальпии диссоциации величину 20 8 1 ккал / моль при 100 С. Херрон и Дибелер [154] исследовали равновесие диссоциации масс-спектроскопическим методом и нашли, что ДЯДИО 21 5 1 6 ккал / моль. Исследуя реакцию методом ЭПР, Пит, Джонсон и др. [155] определили, что ДЯДИС 19 3 1 0 ккал / моль. Кеннеди и Кольбарн [67], обобщая результаты этих работ, пришли к выводу, что наиболее правильным значением ДЯдис является 19 8 0 8 ккал / моль. Исходя из этого значения и стандартной энтальпии образования тетрафторгидразина ( 2 0 2 5 ккал / моль), они рекомендуют для ДЯ; 298 ( NF2) значение 8 9 2 5 ккал / моль. [6]
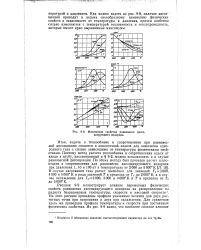 |
Физические свойства равновесно диссоциирующего водо рода. [7] |
Как можно видеть из рис. 9 - 8, наличие диссоциации приводит к весьма своеобразному изменению физических свойств в зависимости от температуры и давления, причем особенно сильно изменяются с температурой теплоемкость и теплопроводность, которые имеют ярко выраженные максимумы. [8]
Определяющей является скорость адсорбции А в отсутствие или при наличии диссоциации А и приближении крмпо-нента В к состоянию равновесной адсорбции. Начальная скорость реакции возрастает быстрее, чем по линейному закону. [9]
 |
Начальные скорости бимолекулярных газовых реакций. Влияние. [10] |
Определяющей является скорость адсорбции А в отсутствие или при наличии диссоциации А и приближении компонента В к состоянию равновесной адсорбции. Начальная скорость реакции возрастает быстрее, чем по линейному закону. [11]
 |
Начальные скорости бимолекулярных газовых реакций. Влияние. [12] |
Определяющей является скорость адсорбции А в отсутствие или при наличии диссоциации А и приближении компонента В к состоянию равновесной адсорбции. Начальная скорость реакции возрастает быстрее, чем по линейному закону. [13]
Определяющей является скорость адсорбции А в отсутствие или при наличии диссоциации А и приближении крмпо-нента В к состоянию равновесной адсорбции. Начальная скорость реакции возрастает быстрее, чем по линейному закону. [14]
Представляет интерес вследствие того, что в ней впервые высказывается предположение о наличии диссоциации и равновесия в растворах. Первое упоминание об этом имеется в лекциях М - ва. [15]
Страницы: 1 2 3