Наличие - электростатическое взаимодействие
Cтраница 1
Наличие электростатического взаимодействия между ионами в растворах электролитов представляет главную причину резкого уклонения свойств растворов особенно сильных электролитов от свойств идеального раствора. [1]
 |
Зависимость эквива. [2] |
Теория растворов сильных электролитов показывает, что особенности сильных электролитов обусловлены наличием электростатического взаимодействия между ионами. Взаимное притяжение между ионами в растворах ведет к образованию ионных атмосфер. Может возникнуть предположение, что движение ионов сильного электролита затрудняется ионными атмосферами. Но предположение, что ион, двигаясь в растворе, перемещается вместе со своей ионной атмосферой, является ошибочным уже потому, что приводит к противоречию с опытом. [3]
Если раствор не предельно разбавлен, то на его свойствах будет сказываться наличие электростатического взаимодействия между ионами. Представим, что это электростатическое взаимодейст-зие внезапно исчезает и раствор становится идеальным. Если, несмотря на это, мы пожелаем сохранить в возникшем идеальном растворе прежние свойства реального раствора, нам необходимо будет изменить его концентрацию. Эта новая концентрация называется эффективной концентрацией, или активность электролита в растворе. [4]
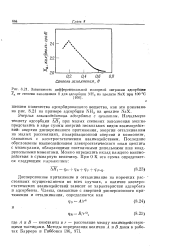 |
Зависимость дифференциальной молярной энтропии адсорбции Sa от степени заполнения 6 для адсорбции NH, на цеолите NaX при 100 С. [5] |
Дисперсионное притяжение и отталкивание на коротких расстояниях осуществляются во всех случаях, а наличие электростатических взаимодействий зависит от характеристик адсорбата и адсорбента. [6]
Эффективность применения ионов для идентификации механизмов (2.6) или (2.7), а также при опытах с фиксированием карбониевых ионов также ограничивается рядом осложнений, вызываемых наличием электростатических взаимодействий более общего типа, и это может оказать более существенное влияние на ход реакции, чем закон действия масс. В общем виде влияние закона действия масс тем важнее и тем легче может быть установлено, чем больше отношение kjk2, и это условие обычно совпадает с большей устойчивостью карбониевых ионов и легкостью их определения другими методами. Влияние взаимодействия зарядов становится все более серьезным при снижении диэлектрической проницаемости среды. В растворах с низкой диэлектрической проницаемостью противоположно заряженные ионы притягиваются так, что в растворе в основном существуют не свободные ионы, а ионные пары или большие агрегаты частиц. Отсюда также следует, что реакции, в которых участвуют такие ионы, не должны подчиняться простым кинетическим уравнениям типа (2.6), выведенным на основании допущения существования кинетически свободных ионов. Влияние образования ионных пар на кинетику обсуждено в разд. [7]
Это объясняется тем, что спиральная конформация молекул поли А возможна лишь при ионизованных группах - NH2 аденина, так как для ее стабилизации недостаточно водородных связей, а требуется также наличие электростатического взаимодействия пуриновых оснований с заряженными фосфатными группами полинуклеотидной цепи. [8]
Особенностью сильных электролитов является их полная электролитическая диссоциация в водном растворе. Это несоответствие обусловлено наличием электростатического взаимодействия образующихся заряженных частиц, ионов, приводящее к образованию ионных пар. Последние отличаются от молекул тем, что ионы в них не соприкасаются непосредственно друг с другом, а разделены одним или несколькими слоями воды, образуя с ними гидратные комплексы. [9]
Это верно, однако, лишь для слабых электролитов, растворы которых содержат сравнительно немного ионов. Напротив, у сильных электролитов, вследствие большого числа ионов, начинает заметно сказываться наличие электростатического взаимодействия ионов друг с другом, результатом чего являются отклонения от закона действующих масс и изменение величины / С при разбавлении раствора. [10]
В то же время цеолиты, как и силикагели, обладают способностью образовывать акцепторно-донорные связи с молекулами, содержащими я-электроны. Однако в отличие от силикагелей акцепторами электронов у цеолитов служат не ионы водорода, а катионы щелочной и щелочноземельной подгрупп периодической системы элементов. Наличие дополнительных электростатических взаимодействий проявляется в большей крутизне изотерм, чем это предсказывается теорией. Все адсорбаты, молекулы которых обладают дипольным и квадрупольным моментами, кратными связями, отличаются повышенными коэффициентами аффинности. [11]
В то же время цеолиты, как и силикагели, обладают способностью образовывать акцепторно-донорные связи с молекулами, содержащими л-электроны. Однако в отличие от силикагелей акцепторами электронов у цеолитов служат не ионы водорода, а катионы щелочной и щелочноземельной подгрупп периодической системы элементов. Наличие дополнительных электростатических взаимодействий проявляется в большей крутизне изотерм, чем это предсказывается теорией. Все адсорбаты, молекулы которых обладают дипольным и квадрупольным моментами, кратными связями, отличаются повышенными коэффициентами аффинности. [12]
С повышением концентрации раствора электростатическое взаимодействие ионов вследствие уменьшения расстояния между ними усиливается. Поэтому скорость их передвижения в электрическом поле уменьшается, что приводит к еще большему снижению электропроводности раствора. Таким образом, наличие электростатического взаимодействия между ионами влияет на свойства раствора так, как влияло бы частичное соединение ионов в молекулы. [13]
Так как константа диссоциации с изменением концентрации раствора не меняется, она дает более общую характеристику электролита, чем степень диссоциации. Это верно, однако, лишь для слабых электролитов, растворы которых содержат сравнительно немного ионов. Напротив, у сильных электролитов начинает заметно сказываться наличие электростатического взаимодействия ионов друг с другом, результатом чего являются отклонения от закона действия масс и изменение величины К при разбавлении раствора. Поэтому в приводимой таблице константы диссоциации ( при обычных температурах) даны только для некоторых слабых электролитов. [14]
Так как константа диссоциации с изменением концентрации раствора не меняется, она дает более общую характеристику электролита, чем степень диссоциации. Это верно, однако, лишь для слабых электролитов, растворы которых содержат сравнительно немного ионов. Напротив, у сильных электролитов начинает заметно сказываться наличие электростатического взаимодействия ионов друг с другом, результатом чего являются отклонения от закона действия масс и изменение величины / С при разбавлении раствора. Поэтому в приводимой таблице константы диссоциации ( при обычных температурах) даны только для некоторых слабых электролитов. [15]
Страницы: 1 2