Беер
Cтраница 1
Беер ( 1858), а вслед за ним Глэдстон и Дейл ( 1859) предложили формулу ( п - i) ld г, которая во многих случаях оказалась лучше формулы Ньютона - Лапласа, а Лоренц ( Lorenz) в 1870 и Ло-рентц ( Lorentz) в 1879 - формулу ( п2 - 1) / ( к2 2) d г. Теоретически в этой формуле не учитывается влияние температуры и давления на удельную рефракцию. На практике в зависимости от природы исследуемых веществ, а в качестве таковых очень широко были использованы органические соединения, или параметров системы ( температура, давление, агрегатное состояние) преимущество отдавалось той или иной формуле и не всегда формуле Лоренца - Лорентца. [1]
Беера пропорционально величине УК и обратно пропорционально величине У С. Очевидно, при больших концентрациях отклонения от этого закона малы, а при сильных разбавлениях они увеличиваются. Уравнение ( 10) позволяет установить границы разбавлений, при которых отклонение для данного окрашенного комплекса достаточно мало. [2]
Беера и метод становится неточным. [3]
Беера и отражается на точности колориметрического определения. [4]
Беер и Мэдлер ( 1837) высказали предположение, что основной причиной неточности наблюдений физической либрации Луны являлось то, что для измерений выбирались такие большие кратеры, как Манилий, расположенные далеко от центра лунного диска. [5]
Беера, что титан представляет собой отличный материал основы анода и для получения хлора если покрыт гальваническим способом сплавами металлической платины. [6]
Беер ( 1825 - 1863) около 1852 г. также исследовал количественно зависимость светопоглощения растворов от концентрации. [7]
Беер ( так же, как и Д. Е. Рознер [3.23]) уравнение сохранения энергии, составленное для равновесно реагирующих газов, приводит к виду уравнения химически инертного потока со слабо изменяющимися физическими свойствами. [8]
Беера не выполняется и окраска разбавленных растворов интенсивнее, чем у более концентрированных. [9]
Беер ( 1858), а вслед за ним Глэдстон и Дейл ( 1859) предложили формулу ( п - i ld - г, которая во многих случаях оказалась лучше формулы Ньютона - Лапласа, а Лоренц ( Lorenz) в 1870 и Ло-рентц ( Lorentz) в 1879 - формулу ( nz - l) / ( w2 - f 2) d г. Теоретически в этой формуле не учитывается влияние температуры и давления на удельную рефракцию. На практике в зависимости от природы исследуемых веществ, а в качестве таковых очень широко были использованы органические соединения, или параметров системы ( температура, давление, агрегатное состояние) преимущество отдавалось той или иной формуле и не всегда формуле Лоренца - Лорентца. [10]
 |
Схема колориметра ( фотометра Дюбоска. [11] |
Закон Беера приложим к молекулярным растворам. [12]
Закон Беера показывает зависимость оцтической плотности раствора от концентрации поглощающих свет частиц. По отношению к окрашенному комплексу XR закон Беера остается правильным, независимо от того, диссоциирует этот комплекс или не диссоциирует. По измерению оптической плотности мы определяем концентрацию вещества XR. Однако это необходимо нам только для того, чтобы рассчитать общую концентрацию определяемого иона. В случае заметной диссоциации комплекса его концентрация, как было отмечено выше, меньше, чем общая концентрация определяемого иона. [13]
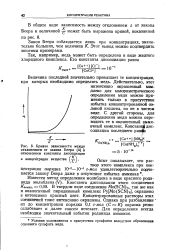 |
Кривая зависимости между отклонением от закона Беера ( Д и отношением константы диссоциации. [14] |
Закон Беера соблюдается лишь при концентрациях, значительно больших, чем величина К. [15]
Страницы: 1 2 3 4