Нарушение - пассивное состояние
Cтраница 4
На кривой потенциал-время стали 08Х22Н6Т в этом случае наблюдается сдвиг потенциала в отрицательном направлении, обусловленный нарушением пассивного состояния стали и локальной активацией поверхности адсорбирующимися ионами хлора. [46]
Кривые показывают, что по мере сдвига потенциала сплавов в положительную сторону поляризуемость резко падает и в дальнейшем, несмотря на увеличение поляризующего тока, значение потенциала остается практически постоянным. Появление на кривых характерной точки перегиба отвечает значению потенциала пробоя, при котором Б данных условиях происходят нарушение пассивного состояния и возникновение точечной коррозии. [47]
Для практического использования вентильного электрода необходимо знать границу потенциалов полностью пассивного состояния титана. При сильном смещении потенциала в положительную сторону возможно пробивание анодной окисной пленки ионами хлора, что приведет к нарушению пассивного состояния и растворению титана. [48]
На рис. 2 сопоставлены катодная и анодная кривые для этого окисла с потенциостатической кривой для никеля. Характерно, что как катодное, так и анодное поведение окисла NiOii2 воспроизводит все характерные особенности никелевого электрода, связанные с возникновением и нарушением пассивного состояния. [49]
Интересна зависимость интенсивности коррозии от ширины зазора. Оказывается, максимальная коррозия наблюдается не при минимальном зазоре, когда доступ реагента ( HNO3, NaNOg) больше всего затруднен, а при некоторых средних зазорах. Такая зависимость обусловлена степенью нарушения пассивного состояния. Чем меньше ширина зазора, тем на большей части поверхности нарушается пассивность, и коррозия приобретает равномерный характер. [50]
В щели накапливаются продукты коррозии. За счет; гидролиза происходит изменение рН среды. В присутствии хлоридов это ведет к нарушению пассивного состояния на сплавах алюминия, хромистых сталях. [51]
Кр зависит от природы аниона, увеличиваясь в ряду нитратборатсульфаткарбонат. При рН10 и концентрации NH4OH0 5 M кинетика анодного растворения и пассивация практически не зависят от природы аммонийной соли. В щелочных растворах в присутствии аммиака / Кр возрастает, а нарушение пассивного состояния ионами NO3 - и SO42 - затрудняется. Плотность тока пассивации в растворах ( NH4) 2CO3 с ростом рН снижается, и в остальных аммонийных растворах [ NH4NO3; ( NH4) 28 ( 1) 4 ] проходит через минимум ( положение которого зависит от концентрации и природы соли) и максимум. Критический потенциал пассивации в исследованных растворах снижается с ростом рН и практически не зависит от природы и концентрации электролита. [52]
На рис. 43 приведены зависимости микроискажений кристаллической решетки аустенитной стали 18 - 10 от числа циклов на-гружения в малоцикловой области, показывающие стадийность усталостного процесса, имеющую различный характер при испытаниях на воздухе и в коррозионной среде. В первом случае достижение уровня микроискажений, приводящего к разрушению, приурочено к концу усталостных испытаний непосредственно перед разрушением, во втором - этот уровень достигается на ранних стадиях нагружения. При этом обнаруживается четкая корреляция между изменениями микродеформаций кристаллической решетки и потенциалами нарушения пассивного состояния: с увеличением уровня микроискажений кристаллической решетки сплава, повышающего химический потенциал его атомов, происходит падение потенциала питтингообразования. [53]
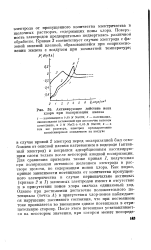 |
Активирующее действие иона хлора при поляризации железа. [54] |
Для сравнения приведена также кривая 1, полученная при поляризации активного железного электрода в растворе щелочи, не содержащем ионов хлора. Как видно, кривые зависимости потенциала от количества пропущенного электричества в случае первоначально активных ( кривые 2 и 1) железных электродов имеют в отсутствие и в присутствии ионов хлора сначала одинаковый ход. Однако при достижении достаточно положительного потенциала ( точка А) в присутствии хлор-ионов наблюдается нарушение пассивного состояния, что при постоянном токе проявляется во внезапном сдвиге потенциала в отрицательную сторону. [55]
При таком пропускании тока поверхность защищаемого металла поляризуется анодно; ее потенциал при этом смещается в положительную сторону, что обычно приводит к увеличению электрохимического растворения металла; однако при достижении определенного значения потенциала может наступить пассивное состояние металла ( что наблюдается при отсутствии депассиваторов в коррозионной среде и приводит к значительному снижению скорости электрохимической коррозии металла), для длительного сохранения которого требуется незначительная плотность анодного тока. На дополнительном электроде - катоде при этом протекает преимущественно катодный процесс. При больших плотностях анодного тока возможно достижение значений потенциала, при которых наступает явление перепассивации ( транспассивности) - растворение металла с переходом в раствор ионов высшей валентности, в результате чего образуются растворимые или неустойчивые соединения ( железо и хром образуют ионы РеС4 - и СгО4 -, в которых Fe и Сг шестивалентны), что приводит к нарушению пассивного состояния и увеличению скорости растворения металла. [56]
Страницы: 1 2 3 4