Нарушение - пассивное состояние - металл
Cтраница 1
Нарушение пассивного состояния металла наблюдается также при катодной поляризации пассивированной поверхности и при контакте с более электроотрицательным металлом. [1]
Нарушение пассивного состояния металла и переход его из пассивного состояния в активное называется активацией. [2]
 |
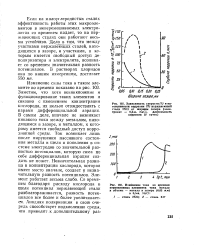
Анодные осциллографические кривые заряжения стали IX18H10T. [3] |
В некоторых случаях нарушение пассивного состояния металла, сопровождающееся увеличением скорости анодной реакции, может наступить и в отсутствие галогенид-ионов, в результате пробоя окисной пленки. Такие явления наблюдаются и в сульфатных электролитах. [4]
Ряд факторов способствует нарушению пассивного состояния металла или активированию его поверхности. [5]
Выполнение данного термодинамического условия определяет принципиальную возможность нарушения пассивного состояния металла и активирования его поверхности. [6]
Кроме того, многие анионы, как уже указывалось, способствуют нарушению пассивного состояния металла вследствие разрушения первичных окисных пленок или вытеснения с поверхности металла кислорода, обусловливающего пассивность. [7]
По достижении определенного потенциала ( Епи на рис. 4.11) снова имеет место рост скорости растворения металла при сдвиге Е в положительную сторону: происходит нарушение пассивного состояния металла, которое принято называть его активацией или перепассивацией. Скорость растворения вновь растет с увеличением положительного значения потенциала. При этом отличие от области активного состояния состоит в том, что металл растворяется с образованием ионов высшей степени окисления. Так, железо в активной области переходит в раствор в виде двухзарядных ионов, а в области перепассивации - в виде трехзарядных ионов. [8]
По достижении определенного потенциала ( Еии на рис. 4.11) снова имеет место рост скорости растворения металла при сдвиге Е в положительную сторону: происходит нарушение пассивного состояния металла, которое принято называть его активацией или перепассивацией. Скорость растворения вновь растет с увеличением положительного значения потенциала. При этом отличие от области активного состояния состоит в том, что металл растворяется с образованием ионов высшей степени окисления. Так, железо в активной области переходит в раствор в виде двухзарядных ионов, а в области перепассивации - в виде трехзарядных ионов. [9]
Перенесение металла, запассивированного в окислительной среде, в неокислительную приводит к переходу пассивного состояния в активное. Нарушение пассивного состояния металла наблюдается также при катодной поляризации пассивированной поверхности и при контакте с более электроотрицательным металлом. [10]
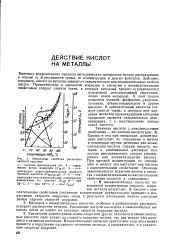 |
Некоторые свойства растворов азотной кислоты. [11] |
Увеличение концентрации ионов хлора или других галогенов в неокислительных кислотах мало влияет на скорость коррозии железа, так как металл уже находится в активном состоянии. В окислительных кислотах присутствие хлор-иона может привести к нарушению пассивного состояния металла, а следовательно, и к увеличению скорости коррозии. [12]
Изложенный выше экспериментальный материал позволяет наметить наиболее вероятный механизм щелевой коррозии нержавеющих сталей. Первопричиной являются различия в концентрации кислорода, приводящие к нарушению пассивного состояния металла в зазоре. Со временем возникают активно-пассивные элементы, функционирующие весьма устойчиво вследствие значительной начальной разности потенциалов. [13]
При потенциале 0 30 В ( рис. 1.5, в) изменяется характер анодного процесса. Образуются ионы металла, дающие растворимые соединения, что приводит к нарушению пассивного состояния металла и увеличению скорости его растворения; процесс сопровождается значительной потерей массы металла. [14]
Страницы: 1 2