Рекомбинантные белок
Cтраница 1
 |
Стабильность при 100 С триозофосфат-изомеразы дрожжей и ее генноинженерных вариантов1. [1] |
Оценка чувствительности рекомбинантных белков к протеолитическому расщеплению показала, что существует положительная корреляция между термостабильностью белка и его устойчивостью к протеолитическому расщеплению. [2]
Для получения гетерологичных рекомбинантных белков с клонированной эукариотической комплементарной ДНК ( кДНК) обычно используются прокариотические системы экспрессии. Однако в некоторых случаях эукариотические белки, синтезированные в бактериях, оказываются нестабильными или биологически неактивными. Чтобы решить эти проблемы, для получения рекомбинантных белков, предназначенных для использования в медицине, были разработаны эукариотические системы экспрессии. Такие белки должны быть идентичны природным по своим биохимическим, физическим и функциональным свойствам. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций. [3]
В некоторых случаях при гиперпродукции рекомбинантных белков образуются как растворимые, так и нерастворимые продукты, что усложняет процедуру очистки. [4]
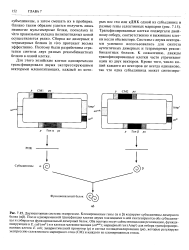
В дрожжевых клетках гликозилируются только секретируемые белки, поэтому для получения рекомбинантных белков, которые для перехода в активную форму должны подвергнуться N-или О-гликозилированию, необходимо использовать системы секреции. Для этого перед кДНК, которая кодирует интересующий исследователя белок, нужно поместить так называемый пре-про-а-фактор - лидерную ( сигнальную) последовательность гена ccj фактора спаривания дрожжей. Синтезируемый рекомби-нантный белок сможет в этом случае эффективно секретироваться дрожжами. [6]
Клонированные целлюлазные гены можно использовать в разных целях: для облегчения очистки рекомбинантных белков с помощью связывающего целлюлозу домена; для получения коммерческих продуктов ( например, этанола) из целлюлозных отходов с помощью микроорганизмов, в которые встроены целлюлазные гены. [7]
Суммируя, можно сказать, что экспрессиру-ющие векторы млекопитающих столь же универсальны и эффективны, как и векторы для других эукариотических систем экспрессии, если речь идет о получении аутентичных рекомбинантных белков для исследовательских и медицинских целей. Однако промышленный синтез рекомбинантных белков с использованием модифицированных клеток млекопитающих обходится слишком дорого. [9]
Суммируя, можно сказать, что экспрессиру-ющие векторы млекопитающих столь же универсальны и эффективны, как и векторы для других эукариотических систем экспрессии, если речь идет о получении аутентичных рекомбинантных белков для исследовательских и медицинских целей. Однако промышленный синтез рекомбинантных белков с использованием модифицированных клеток млекопитающих обходится слишком дорого. [10]
Часто думают, что выращивание больших количеств микроорганизмов представляет собой рутинную процедуру. Однако для успешного производства рекомбинантных белков в промышленных масштабах необходимо контролировать множество параметров, от которых зависит рост синтезирующих их микроорганизмов и чистота получаемых продуктов. [11]
Чтобы решить эти проблемы, были сконструированы векторы, содержащие оба клонированных гена. А для того чтобы гарантировать синтез рекомбинантных белков в одинаковом количестве, были созданы так называемые двухцистронные векторы, в которых клонированные гены разделялись сегментом ДНК, содержащим внутренний сайт связывания рибосом. [12]
Системы с двумя векторами успешно использовались для синтеза аутентичных димерных и тетрамерных рекомбинантных белков. К сожалению, дважды Трансфицированные клетки часто утрачивают один из двух векторов. [14]
Внехромосомные экспрессирующие векторы млекопитающих используются для изучения функций и регуляции генов млекопитающих. Кроме того, с их помощью могут быть получены аутентичные рекомбинантные белки, которые потенциально могут использоваться в медицинских целях для лечения некоторых заболеваний человека. Уже сконструированные экспрессирующие векторы млекопитающих весьма многочисленны, но все они обладают сходными свойствами и похожи на другие эукариотические экспрессирующие векторы. [15]
Страницы: 1 2