Железосерные белок
Cтраница 1
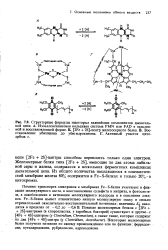
Железосерные белки обычно входят в состав электрон-транспортных цепей. Было показано, что они также могут быть объектом исследования методом ЯМР. Например, методом ЯМР было-проведено сопоставление свойств двух таких белков - ферредок-сина и рубредоксина из Clostridium pasteurianum. Ферредоксин из этого источника содержит 6 - 8 атомов железа в молекуле и вступает в двухэлектронные реакции окисления и восстановления. Показано, что атомы серы восьми цистеиновых остатков связаны с железом одновременно с кислотнолабильной серой. Последующее изучение температурной зависимости спектров ЯМР показало, что возможно существование магнитной восприимчивости двух типов. Магнитная восприимчивость восстановленного ферредоксина подчиняется закону Кюри, тогда как магнитная восприимчивость окисленного ферредоксина увеличивается с повышением температуры. Отсюда был сделан вывод о наличии интенсивного антиферромагнитного взаимодействия между атомами железа. По-скольку и окисленный, и восстановленный ферредоксин парамагнитен, можно ожидать, что железосодержащие центры будут возмущать спектр протонного магнитного резонанса белка. В спектре ферредоксина имеется восемь резонансных сигналов, сильно сдвинутых в слабое поле, интенсивность которых, по данным сопоставления со стандартом, соответствует восьми протонам на моль белка. Температурная зависимость положений этих сигналов коррелирует с температурной зависимостью магнитной восприимчивости, так что сдвиги, вероятно, обусловлены контактным механизмом. [1]
Железосерные белки входят в состав комплексов I, II, III дыхательной цепи митохондрий, выполняя роль второй простетической группы в процессе транспорта электронов. [2]
Железосерные белки принимают и отдают электроны по одному. Эти электроны передаются небольшой кольцеобразной молекуле - окисленной форме убихинона ( рис. 38), называемой коферментом убихиноном ( вездесущий хинон) и обозначаемой буквой Q. В полностью окисленном состоянии ( без двух атомов водорода) оба атома кислорода присоединены к кольцу двумя химическими связями. [3]
Железосерные белки типа [ 2Fe 2S ], имеющие по два атома лабильной серы и железа, содержатся в нескольких ферментных комплексах дыхательной цепи. Из общего количества находящегося в плазматической мембране железа 80 % содержится в Fe-S - белках и только 20 % - в цитохромах. [5]
Данные об образовании конформационно неравновесных состояний железосерных белков, играющих важную роль во внутриклеточной трансформации энергии, будут рассмотрены позже. В конце этого параграфа будут описаны различные методы получения неравновесных форм белков в растворах при комнатной температуре. До настоящего времени этой техникой было исследовано несколько сотен белков, зарегистрирована кинетика их релаксации и установлены их физические и химические свойства. Здесь будут даны только принципиальные выводы из результатов этих исследований. [6]
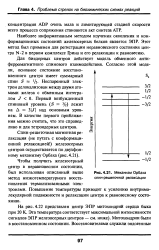 |
Механизм Орбаха спин-решеточной релаксации. [7] |
Наиболее информативным методом изучения окисления и кон-формационных состояний железосерных белков является ЭПР. Этот метод был применен для регистрации неравновесного состояния центра N-2 в первом комплексе Грина и его релаксации к равновесию. [8]
Помимо транспорта электронов в мембранах Fe-S - белки участвуют в фиксации молекулярного азота, в восстановлении сульфита и нитрита, в фотосинтезе, в освобождении и активации молекулярного водорода и в окислении алка-нов. Некоторые железосерные белки получили название по своему происхождению или по функции: ферредок-син, путидаредоксин, рубредоксин, адренодоксин. [9]
Ферменты переноса электронов и окислительного фосфорилирова-ния, находящиеся у эукариот в митохондриях, у бактерий локализуются внутри или на поверхности плазматической мембраны. Цитохромы, железосерные белки и другие компоненты электрон-транспортной цепи находятся исключительно в мембранах. [10]
Молекулы убихинона растворимы в липидном слое мембраны, поэтому они могут мигрировать от одной стороны мембраны к другой. Молекулы убихинона осуществляют перенос электронов от железосерных белков к другим составным частям цепи электронного транспорта митохондрий, которые называются цитохромами. Механизм такого переноса недостаточно ясен. Основными элементами цепи электронного транспорта, которую часто называют дыхательной цепью митохондрий, являются пять различных молекул цитохромов. [11]
В этой схеме компоненты дыхательной цепи располагаются в порядке возрастания окислительно-восстановительных потенциалов. Кроме цитохромов в дыхательную цепь входят молекулы флавин-мононуклеотида, железосерные белки, молекулы убихинона и некоторые другие белковые молекулы. Молекулы НАД являются главным связующим звеном между циклом лимонной кислоты и цепью электронного транспорта, через которую пара электронов передается атому кислорода. [12]
Фосфорилирование, сопряженное с переносом электронов. Предположение о такого рода фосфорилировании у сульфатредуцирующих бактерий основано на данных о наличии цитохромов и железосерных белков в плазматических мембранах, а также о высоком выходе энергии. [13]
БЫЛО показано, что атом меди находится в координационном окружении слегка искаженных тетраэдров, которые образуются в результате координирования его с S Н - группой цистеина и имидазрльным атомом азота из фрагмента гистидина. Как ожидают, циклические политиаэфиры окажутся мощным инструментом для изучения структуры медьсодержащих белков, так же как и структуры и действия железосерных белков. [14]
БЫЛО показано, что атом меди находится в координационном окружении слегка искаженных тетраэдров, которые образуются в результате координирования его с S Н - группой цистеина и имидазольным атомом азота из фрагмента гистидина. Как ожидают, циклические политиаэфиры окажутся мощным инструментом для изучения структуры медьсодержащих белков, так же как и структуры и действия железосерных белков. [15]
Страницы: 1 2