Исследованные белок
Cтраница 1
Программы исследованных белков отличаются между собой так, что по ним можно проводить идентификацию даже близких белков. Так например, не составляет большого труда обнаружить различие в пнрограммах рибонуклеазы и дезоксирибонуклеазы. [1]
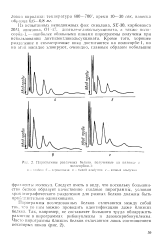 |
Пирограммы различных белков, полученные на колонке. [2] |
Ппрограммы исследованных белков отличаются между собой так. Так, например, не составляет большого труда обнаружить различие в пирограммах рибонуклеазы и дезоксирибонуклеазы. [3]
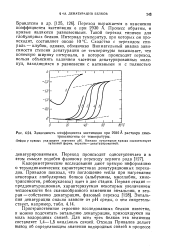 |
Зависимость коэффициента экстинкции при 2930 А раствора химо-трипсиногена от температуры. [4] |
Пространственное строение исследованных белков известно, и можно подсчитать энтальпию денатурации, приходящуюся на моль водородных связей. Для всех трех белков эта величина составляет 1 4 - 1 5 ккал / молъ связей. [5]
Как уже было отмечено, конформационно неравновесные состояния всех исследованных белков с повышением температуры релак-сируют к соответствующим равновесным состояниям еще до размораживания матрицы. [6]
Спираль с внутримолекулярными водородными связями является наиболее стабильной конфигурацией полипептидной цепи, представленной в большинстве исследованных белков. Однако она не является их единственной конфигурацией. [7]
На рис. 2 а показано, что для данной соли увеличение IgS прямо пропорционально ионной силе; эта зависимость является выражением предельного закона при достаточно малых концентрациях ионов, причем указанный эффект различен для разных исследованных белков или аминокислот. [8]
Молекулы исследованных белков не имеют особой слабой точки, которая могла бы быть повреждена прямым действием с образованием заметных изменений при малых дозах. Александер и Чарлзби [55] показали, что сывороточный альбумин в сухом состоянии подвержен изменениям в результате прямого действия при облучении очень высокими дозами. Кениг и Перрингс [58] нашли, что рентгеновские лучи вызывают расщепление фибриногена с образованием как самых мелких фрагментов, так и больших агрегатов, в том числе нерастворимых. [9]
Такой препаративный метод, несмотря на то что он далек от совершенства ( потеря от 1 / 3 до 1 / 2 всей массы аминокислот), был большим шагом вперед. Вскоре было выяснено, что в состав подавляющего большинства исследованных белков входят L-a - аминокислоты из числа помещенных в табл. 87, и лишь редкие белки содержат какие-либо аминокислоты сверх этих. В таблице выделены жирным шрифтом незаменимые в пище человека и животных аминокислоты, потребление которых должно составлять в сумме 21 - 31 г в сутки. [10]
Бергман был твердо уверен, что эти закономерности являются точными следствиями экспериментальных данных. Но необходимо отметить, что несмотря на тщательность отдельных определений, общее число исследованных белков было весьма незначительным. [11]
Френкель-Конрат [ 147г ] исследовал характер присоединения ангидрида М - карбокси - / - лейцина, меченного изотопом С14 в цепи. Он приготовил производные большого числа белков и определял положение лейцина методом ДНФБ, путем разложения по способу Здмана и посредством измерения радиоактивности. Изученная им реакция является, повидимому, специфической по отношению к аминогруппам, но у всех исследованных белков е-аминогруппы лизина блокировались только частично и N-КОЙ - - цевые группы в большинстве случаев замещались неполностью. [12]
Далее из гидролизатов белков были выделены и другие аминокислоты, и вплоть до середины XX века продолжалось открытие более экзотических аминокислот. Метод Фишера состоит в том, что смесь аминокислот, полученную в результате гидролиза с помощью концентрированной соляной кислоты, превращают этерификацией посредством этанола и НС1 в сложные эфиры аминокислот, освобождают их от солеобразно связанной НС1 путем добавления щелочи и разделяют эфиры фракционной перегонкой в вакууме. Такой препаративный метод, несмотря на то что он далек от совершенства ( потеря от / з До Vz всей массы аминокислот), был большим шагом вперед. Вскоре было выяснено, что в состав подавляющего большинства исследованных белков входят L-a - ами-нокислоты из числа помещенных в табл. 88, и лишь редкие белки содержат какие-либо аминокислоты сверх этих. В таблице выделены жирным шрифтом незаменимые в пище человека и животных аминокислоты, потребление которых должно составлять в сумме 21 - 31 г в сутки. [13]
Были представлены веские доказательства того, что дисульфидные группы имеют особенное значение также в тех случаях, когда молекулы подвергаются действию прямых ударов. Хотя, как указывалось раньше, начальные ионизации органических молекул распределяются равномерно, дисульфидные связи селективно подвергаются воздействию при таких условиях. Это ясно показано в исследованиях Энгельгарда ( Engelhard) и др. [266], касающихся химических изменений альбумина сыворотки вследствие облучения ультрафиолетовым светом. Были получены характерные формы резонанса, подтверждающие то, что большинство электронов, возникающих вследствие облучения, находится на SS-группах половин цис-тина. Shields) [145, 149] следующим образом резюмировали свою самую последнюю работу, выполненную на ряде белков: Большинство, хотя и не все, исследованных белков дает или двойную резонансную характеристику глицил-глицина, зависящую от поля резонансную характеристику цистина, или же сочетание обеих характеристик. [14]
Страницы: 1