2-аминоантрахинон
Cтраница 2
Фильтрат и кислоту после промывания 2-аминоантрахинона объединяют и разбавляют водой в стакане емкостью 1 5 л так, чтобы концентрация кислоты была 35 %; нагревают до растворения выделившегося осадка, добавляют около 200 г сульфата натрия так, чтобы получить 20 % - ный раствор, наставляют для кристаллизации на 48 часов. [16]
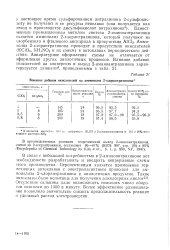 |
Влияние добавок окислителей на аммонолиз 2-хлорантрахинона. [17] |
В производственных условиях теоретический выход 2-аминоантрахинона, считая на 2-хлорантрахинон, составляет 86 - 87 % ( BIOS 987, стр. [18]
Получается в промышленных условиях сплавлением 2-аминоантрахинона со смесью едкого кали, едкого натра и уксуснокислого натрия в присутствии окислителей. [19]
В производственных условиях теоретический выход 2-аминоантрахинона, считая на 2-хлорантрахинон, составляет 86 - 87 % ( BIOS 987, стр. [20]
Кубовый синий О получают окислительной конденсацией 2-аминоантрахинона в среде расплавленной щелочи. В производстве этот процесс называют щелочным плавлением. [21]
Описан [297] непрерывный метод щелочного плавления 2-аминоантрахинона, в котором благодаря уменьшению вспенивания и местных перегревов достигается уменьшение образования побочных продуктов. Достигнут выход 65 9 %, но процесс, по-видимому, неприменим в промышленности. [22]
Индантрен ( I) получается при сплавлении 2-аминоантрахинона с КОН и нитратом калия при 250 С. [23]
Трудно объяснить присоединение аниона LV6 в 1-положение 2-аминоантрахинона, которое не является электронодефицитным центром, уязвимым для нуклеофильной атаки. Во всяком случае, соответственно замещенные производные анилина не вступают в подобные реакции и не образуют феназинов; уникальность ами-ноантрахинрна в данной связи нуждается в объяснении. [24]
При пропускании раствора смеси 1 - и 2-аминоантрахинонов в смеси толуола и пиридина через колонку из специально приготовленной окиси аллюминия и проявлении смесью тех же растворителей 1-изомер количественно вымывается из колонки, а 2-изомер задерживается в ней. В верхней части колонки образуются фиолетовые зоны, вероятно вследствие наличия 1 2 - и 1 4-диаминоантрахинонов в техническом 1-аминоантрахиноне. [25]
Получается: 1) действием пятихлористой сурьмы на 2-аминоантрахинон; 2) сплавлением 2-аминоантра-хинона с едким кали при 330 - 350 с прибавлением окисляющих средств, как, например, селитры. [26]
Флавантрон может быть также получен конденсацией двух молекул 2-аминоантрахинона в присутствии пятихлористой сурьмы в среде нитробензола. [27]
Согласно предположению Шолля и Эберли [279] в результате присоединения 2-аминоантрахинона ( LVa) к енолу LV6 образуется дианион LVI; повторение реакции ведет к получению индантрона. Ниже показан ионный механизм образования индантрона из 2-аминоантрахинона ( см. стр. [28]
Бснзоилирование ослабляет адсорбцию как 1 -, так и 2-аминоантрахинонов, но это вызывается разными причинами. [29]
Работы последнего времени65 показывают, что при щелочном плавлении 2-аминоантрахинона образуется, видимо, анион ( I), реагирующий с амином. [30]
Страницы: 1 2 3 4