Нитрование - метан
Cтраница 1
Нитрование метана имеет большое значение и в промышленности. Нитрометан является единственным нитропарафином, который способен к детонации и вызывает взрывной эффект больший, чем тринитротолуол [94], но детонирует он значительно труднее, чем последний. Нитрометан, кроме того, является отличным селективным растворителем. [1]
Нитрование метана протекает труднее. В продуктах нитрования метана, наряду с литромета-ном, получающимся с незначительным выходом, установлено образование полинитропроизводных до тетранитрометака включительно. [2]
Нитрование метана протекает хуже. [3]
Для нитрования метана требуются более жесткие условия реакции. [4]
При нитровании метана в качестве продуктов реакции получены нитрометан ( с небольшим выходом) и полинитросо-единения до тетранитрометана включительно. [5]
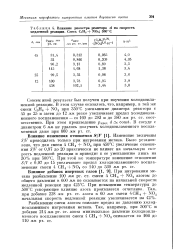 |
Влияние диаметра реактора d на скорость медленной реакции. Смесь СзН8 - - NCb. 350 С. [6] |
При нитровании метана разбавление 100 мм рт. ст. смеси 4 СН4 N02 азотом до общего давления в 600 мм не сказывается на начальной скорости медленной реакции при 425 С. При повышении температуры до 500 С ускоряющее влияние азота проявляется отчетливо. [7]
При нитровании метана или нитрометана тетрани-трометан не образуется. Реакционная способность атомов водорода в метане и нитрометане настолько низка, что для их замещения необходимы жесткие условия, вызывающие значительное разложение нитрометана; полинитрометаны еще менее стабильны, и при этих условиях разлагаются полностью. [8]
При нитровании метана в качестве продуктов реакции получены нитрометан ( с небольшим выходом) и полинитросо-единения до тетранитрометана включительно. [9]
При нитровании метана в качестве продуктов реакции получены нитрометан ( с небольшим выходом) и по линитрос седине ния до тетранитроме-тана включительно. [10]
 |
Влияние диаметра реактора d на скорость медленной реакции. Смесь СзН8 NOa. 350 С. [11] |
При нитровании метана разбавление 100 мм рт. ст. смеси 4 СН4 N02 азотом до общего давления в 600 мм не сказывается на начальной скорости медленной реакции при 425 С. При повышении температуры до 500 С ускоряющее влияние азота проявляется отчетливо. [12]
При нитровании метана объемом 2 8 л ( нормальные условия) получена смесь нитрометана и динит-рометана массой 7 85 г. Вычислите массовую долю нитрометана в полученной смеси. [13]
Энергия активации нитрования метана ( 150 - 500 С, динамическая система) составляет около 217 9 кДж / моль. У высших гомологов метана значения энергии активации приблизительно одинаковы. [14]
Исследован состав продуктов нитрования метана и пропана. Было установлено, что нитрование алканов является цепной разветвленной реакцией, в которой благодаря большой скорости инициирования цепей наблюдается стационарное протекание процесса. Осуществление цепи при нитровании алканов обусловлено образованием в ходе реакции возбужденного алкилнитрита, распад которого с образованием алкоксильного радикала НО дает вслед за таким энергетическим звеном возможность развития материальной цепи. При этом вместо малоактивной радикало-подобной частицы N02 образуется активный ацильный радикал RCO. Предложена радикальная схема этой реакции и определены отношения констант скоростей основных элементарных стадий. [15]
Страницы: 1 2 3 4