Толстая нить
Cтраница 1
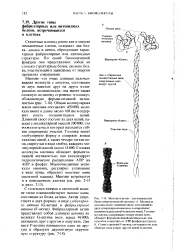
Толстые нити образованы белком миозином. Каждая толстая нить окружена шестью тонкими. К каждой из головок нековалентно присоединены по две, легкие цепи. С-конец тяжелой цепи имеет конформацию а-спирали. Головка миозина присоединена к остальной части молекулы гибким участком. Это позволяет ей обратимо присоединяться к актину. Палочкообразные хвосты молекул миозина могут соединяться друг с другом, образуя пучки. Головки располагаются вокруг пучка по спирали. В области Af-линии пучки соединяются хвост к хвосту, образуя миозиновые нити саркомера. [1]
 |
Схема, функциональной единицы миофибриллы - саркомера - в покоящемся ( о и сокращенном состояниях ( б. [2] |
Толстые нити имеют длину порядка 1500 нм и диаметр 14 нм и могут при определенных условиях скользить между ними. Основным компонентом толстых нитей является миозин. Тонкие нити состоят из / - актина и содержат еще два белка, принимающих участие в запуске мышечного сокращения, - тропомиозин и тропонин. [3]
Толстые нити занимают центральную часть Осаркомера. Они имеют длину 1 5 мкм и диаметр около 150 - 170 А. В поперечном сечении толстые нити располагаются в виде гексагональной структуры на расстояниях около 450 А одна от другой. Тонкие нити имеют длину около 1 мкм и диаметр примерно 60 А. Они начинаются от Z-пластинок и тянутся к центру саркомера, заканчиваясь у края Я-зоны Л - диска. [4]
Толстые нити состоят из белков одного типа - миозина. Молекула миозина с молекулярной массой 5 10 дальтон походит на тонкий прут диаметром около 40 А и длиной 1600 - 1700 А с двумя выступами на одном конце. Она составлена из двух полипептидных цепей, содержащих каждая примерно по 1800 аминокислотных остатков. Следовательно, это наиболее длинные из известных в настоящее время полипептидных цепей. На большом протяжении каждая полипептидная цепь имеет конфор-мацию а-спирали. На одном конце миозиновой молекулы обе полипептидные цепи скручены в глобулы, которые называются головами миозиновой молекулы. Они имеют размеры 200 X 40 А. В головах миозиновой молекулы имеются очень важные ферменты, участвующие в биохимических процессах. [5]
 |
Структура миофибрилл. [6] |
Основой толстой нити является молекула миозина. [7]
В толстой нити, имеющей форму сигары, содержится около 200 - 400 молекул миозина. Они укладываются так, что головы молекул направлены к обоим концам нити, а хвосты - к середине. В средних сечениях толстой нити наложены друг на друга 20 - 30 молекул. По окружности нити на всемоее протяжении, кроме средней части ( Я-зоны), примерно на 100 А над поверхностью выступают шесть рядов голов миозиновых молекул. В каждом ряду имеется около 30 голов. Каждая пара голов повернута на 120 относительно соседней пары. Расстояние между соседними головами, имеющими одинаковое направление, равно приблизительно 429 А. Таким образом, толстая нить образует структуру с винтовой осью третьего порядка. Важные сведения о периодической структуре мышечных волокон получены Хансон [145] при рентгеновских диффракционных исследованиях. [8]
С толстыми нитями в скелетной мышце тесно взаимодействуют тонкие нити, состоящие из белка актина. Фибриллярный актин представляет собой длинную цепочку из молекул G-актина ( мол. [10]
Обращение с более толстыми нитями ( диаметром более 5 мк) является несложным, но операции с очень тонкими нитями, которые непосредственно не видимы, требуют известной техники. Прежде всего рекомендуется армировать оба конца закрепленных на планках нитей. [11]
К техническим причисляются относительно толстые нити повышенной прочности и повышенной крутки, применяемые в основном-при изготовлении пневматических шин и резиновых технических изделий. [12]
В результате расширения толстых нитей головы миозиновых молекул прижимаются к тонким нитям. [13]
В сократительной системе мышцы толстые нити ( состоящие из молекул миозина) и тонкие нити ( состоящие из G-актина) уложены параллельными рядами. [14]
В пахитене ( стадия толстых нитей) происходит кроссинговер. Диплотена ( стадия двойных нитей) начинается взаимным отталкиванием гомологов и появлением хиазм; у подавляющего большинства организмов в диплоте-не происходит дальнейшая спирализа-ция хромосом и редукция числа ядрышек; лишь в ооцитах животных, накапливающих много желтка ( нек-рые рыбы, земноводные, птицы, млекопитающие), а также в спер-матоцитах нек-рых насекомых хромосомы, наоборот, деконденси-руются и приобретают вид ламповых щеток; разрыхление хромосом сопровождается активацией процессов синтеза РНК и белка. Это наиболее длит, период профазы I. У насекомых хромосомы типа ламповых щеток могут существовать год и более, у человека - 12 - 50 лет. Длядиа-к и н е з а ( стадия обособления двойных нитей) характерны уменьшение числа хиазм и значит, компактность бивалентов. [15]
Страницы: 1 2 3 4 5