Более высокий атомный номер
Cтраница 2
Поэтому каждое из них претерпевает последовательные р-превра-щения, образуя в конечном счете устойчивый изотоп соответствующего элемента с более высоким атомным номером. [16]
Поэтому каждое из них претерпевает последовательные ( i-превращения, образуя в конечном счете устойчивый изотоп соответствующего элемента с более высоким атомным номером. [17]
 |
Схема деления заряженной капли.| Деление ядра урана. [18] |
В связи с этим каждое из них претерпевает - превращения, образуя в конечном счете устойчивый изотоп элемента с более высоким атомным номером. [19]
Поиск следующих за ураном - так называемых трансурановых - элементов начался еще в 1934 году, когда итальянец Эн-рико Ферми обнаружил, что при бомбардировке элементов недавно открытыми элементарными частицами нейтронами ( см. главу 6) часто наблюдалось превращение этого элемента в другие - п с более высокими атомными номерами. Возник вопрос: а нельзя ли превратить уран в следующий по порядку элемент номер 93, то есть полностью синтетический по своей природе элемент. [20]
Если заместителями у асимметрического атома углерода являются два атома с одним и тем же атомным номером ( например, два других атома углерода), принимают во внимание атомный номер заместителей у этих присоединенных атомов. Атом с - заместителем, имеющим более высокий атомный номер, помещают перед атомом, заместитель которого имеет меньший атомный номер. Порядок старшинства часто встречающихся заместителей у асимметрического углерода следующий: I, Br, Cl, SH, ОН, NO2, NH2, GOOR, СООН, СНО, CR2OH, CHOHR, CH2OH, C6HS, CH2R, CH3, H. Атомы, связанные двойной и тройной связямл, считают соответственно дважды или трижды. [21]
Помимо естественных, в настоящее время существуют искусственные изотопы, полученные практически для всех элементов периодической системы. Путем искусственных радиоактивных превращений были также получены трансурановые элементы, ранее неизвестные и имеющие более высокие атомные номера, чем уран, являвшийся последним элементом в периодической системе. Трансураны, именуемые также актинидами, образуют четвертое радиоактивное семейство - семейство нептуния. [22]
Особенно важен тот факт, что некоторые элементы не имеют устойчивых изотопов. Начиная с полония ( атомный номер 84), ни один из элементов с более высоким атомным номером не имеет никаких устойчивых изотопов. Некоторые из них, например уран и торий, были найдены в природе в существенных количествах, поскольку у них есть по крайней мере один очень долгоживущий изотоп. Ряд элементов ( Ra, Rn) обнаружен в малых количествах. Их содержание поддерживается постоянным, так как они непрерывно возникают как продукты расщепления при данном радиоактивном распаде. Другие, такие, как At и Fr, не имеют ни одного достаточного долгоживущего изотопа и отсутствуют в природе в макроколичествах. [23]
Этот приближенный метод часто употребляется и является достаточно точным, особенно при обычно применяемых экспериментальных методах и для атомов с довольно высоким атомным номером. После замены атомного фактора через атомный номер возможно дальнейшее упрощение, которое часто производится, а именно: можно пренебрегать рассеянием легкими атомами по сравнению с рассеянием атомами с более высоким атомным номером. Для хлорпроизводных бензола, например, полное рассеяние выражается через члены для атомов водорода, углерода и хлора, и-также для атомных пар водород - водород, углерод - углерод, водород - углерод, хлор - хлор и углерод - хлор. [24]
Из оптических данных известно ( гл. III), что атомные валентные оболочки, имеющие более высокое главное квантовое число, легче поляризуются, чем аналогичные оболочки с более низким квантовым числом; очевидно, в атомах с более высоким атомным номером на поляризуемость значительнее влияет большее расстояние валентных электронов от ядра, нежели большая неполнота экранирования внутренними электронами. Так как оптические данные показывают, что связи более поляризуемы вдоль, чем поперек ( гл. III), то можно ожидать, что для аналогичных валентных оболочек изменения индуктомерной поляризуемости повторяют изменения полной поляризуемости. [25]
Элементы от лития до фтора могут образовывать до четырех таких связей, так как L-оболочка дает одну s - и три р-орбиты ( sp3) для привлечения пожертвованных электронных пар. Пространственное расположение этих связей составляет тетраэдр. Элементы с более высокими атомными номерами способны к введению в действие d - уровней и могут координировать вокруг себя шесть электронных пар с октаэдрической симметрией на гибридизованных двух d -, одной 5 - и трех / - орбитах ( d sp3), как, например, ионы трехвалентного железа или кобальта. [26]
Элементы от лития до фтора могут образовывать до четырех таких связей, так как Х - оболочка дает одну s - и трйр-орбиты ( sps) для привлечения пожертвованных электронных пар. Пространственное расположение этих связей составляет тетраэдр. Элементы с более высокими атомными номерами способны к введению в действие й-уровней и могут координировать вокруг себя шесть электронных пар с октаэдрической симметрией на гибридизованных двух d -, одной - s - и трех jo - орбитах ( d2sp3), как, например, ионы трехвалентного железа или кобальта. [27]
Погашение линии происходит потому, что некоторая часть эмиссии находится ниже поверхности пробы и, следовательно, может быть поглощена при прохождении через вещество. Усиление возникает, когда линии флуоресценции основного вещества имеют достаточно короткую длину волны, чтобы возбудить спектр определяемого элемента. Это может произойти, если основа состоит из элементов с более высоким атомным номером, чем определяемый. [28]
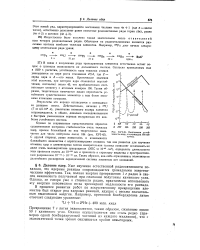 |
Ожидаемая устой-чается для числа нейтронов около 184 ( XVI-45. чивоиь ядер, содержащих 184 ней. [29] |
В связи с получением ряда трансурановых элементов естественно встает вопрос о границах возможности их дальнейшего синтеза. Согласно проведенным еще в 1939 г. расчетам, устойчивость ядер тяжелых атомов уменьшается по мере роста отношения Z2 / / 4, где Z - заряд ядра и Л - его масса. Таким образом, теоретически намечается малая вероятность устойчивого существования элементов с еще более высокими атомными номерами. [30]
Страницы: 1 2 3