Порядковый номер - атом
Cтраница 2
Постройте графическую зависимость температуры плавления этих соединений от порядкового номера элемента-центрального атома и объясните, почему эта зависимость не является монотонной. [16]
Число электронов в электронной оболочке нейтрального атома определяется порядковым номером атома в периодической системе Z. Например, электронная оболочка атома натрия - 11-го элемента системы Менделеева - состоит из 11 электронов, а оболочка менделевия ( Z101) - из 101 электрона. Заряд ядра натрия, следовательно, равен 11е11 - 4 803 10 - 10 эл. [17]
Следует помнить, что чем больше разница в порядковых номерах атомов, составляющих структуру, тем труднее выявить на распределении электронной плотности слабые максимумы, отвечающие легким атомам. Часто наиболее легкие атомы фиксируются очень приблизительно или даже вообще не могут быть зафиксированы в распределении; соответствующие максимумы теряются в склонах более мощных пиков или в несколько неравномерном фоне - ходе электронной плотности между высокими максимумами ( подробнее об этом фоне см. стр. Это относится, в частности, к атому водорода, единственный и подвижный электрон которого дает весьма слабое и размытое электронное облако. Даже в чисто органических структурах, состоящих из одних атомов углерода и водорода, без применения специальных приемов исследования редко удается обнаружить максимумы, фиксирующие положение водорода ( подробнее см. гл. [18]
Кажущиеся радиусы атомов в валентном состоянии 4 растут с увеличением порядкового номера атома, в связи с чем их окислительная способность падает; исключение составляет РЬ4, являющийся очень сильным окислителем. [19]
Из рисунка 18 видно, что энергия ионизации является периодической функцией от порядкового номера атома. С возрастанием порядкового номера в пределах каждого периода ЭЙ в целом повышается. Таким образом, оторвать от атома электрон становится все труднее по мере возрастания заряда ядра, числа внешних электронов в атоме и убывания радиуса атома, что связано с возрастанием при этом притяжения электронов к ядру. В малых периодах ЭЙ, как и радиусы атомов, изменяются с изменением порядкового номера элемента гораздо быстрее, чем в больших, из-за описанного выше эффекта экранирования внешних электронных слоев в d - и / - элементах, при накоплении ( п - 1) с / - электронов или ( п - 2) / - электронов в их атомах. [20]
Внутри одной и той же периодической группы размер атомов возрастает с увеличением порядкового номера атома. [21]
По женевской номенклатуре названия гликолей имеют окончание диол; местоположение гидроксилов указывается порядковым номером атомов углерода, при которых они находятся. [22]
Поэтому потеря интенсивности пучка - - - лучей в этой области приблизительно пропорциональна порядковому номеру атома и плотности среды. [23]
Нормальные сульфиды ( средние) мало растворимы в воде; растворимость их с увеличением порядкового номера атома повышается. [24]
Число нейтронов в ядре NA - Z, где Z - атомный номер ядра, равный порядковому номеру атома в периодической системе. Заряд ядра равен Ze. Ядра, у которых число нейтронов или протонов равно одному из следующих чисел: 2, 8, 20, 28, 50, 82 и 120, называются магическими ядрами, а сами числа - магическими числами. Такие ядра имеют наибольшую стабильность. [25]
Наконец, если в молекуле содержится несколько двойных связей, то необходимый символ используется вместе с порядковым номером соответствующего атома углерода, определенным по номенклатуре IUPAC. Например, соединение ( 70) следует называть 2Е - 5-хлоргексадиен - 2 4-овой кислотой. [26]
Как видно из этой таблицы, величина расщепления первого возбуж-енного 2Р - терма резко возрастает с увеличением порядкового номера атома Z. Это связано со следующим обстоятельством. [27]
В отличие от рентгеновских и электронных амплитуд, которые можно рассчитать и которые монотонно растут с увеличением порядкового номера Z атома, ядерные амплитуды рассеяния нерегулярно меняются в зависимости от массового числа М и не могут быть теоретически вычислены по ряду причин. Значения а приходится определять из опытов по рассеянию нейтронов веществом. [28]
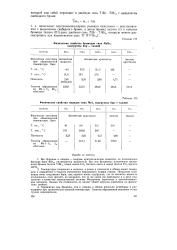 |
Физические свойства иодидов типа Ме13 подгруппы бор - таллий. [29] |
Температуры плавления и кипения, а равно и плотности в общем имеют тенденцию к повышению в сторону увеличения порядкового номера атомов. Несколько особняком стоят соединения бора, как первого члена подгруппы, что не является каким-то отклонением, если принять во внимание, что то же самое мы наблюдали и в двух подгруппах s - элементов периодической системь. Однако эта особенность не меняет общей картины изменения их физических свойств. [30]
Страницы: 1 2 3 4