Нормальность - стандартный раствор
Cтраница 1
Нормальность стандартного раствора вычисляют либо по данным титрования при стандартизации, либо по данным, полученным в процессе его приготовления. [1]
Если нормальность стандартного раствора выражена при помощи поправки, то концентрацию анализируемого раствора выражают также при помощи поправки к той же эталонной нормальности. Если умножить объемы растворов, взаимодействующих при титровании, на соответствующие поправки, то получим объемы растворов одной и той же нормальности. Растворы одинаковой нормальности, как известно, реагируют в равных объемах. [2]
Определить нормальность стандартного раствора, полученного растворением в мерных колбах на 500 мл 3 0000 г MgSO4 ( безводного) и 2 5000 г СаСО3, если затем 25 мл первого раствора смешать в мерной колбе на 200 мл с 75 мл второго и долить водой до метки. [3]
Зная объем и нормальность стандартного раствора титранта, израсходованного на титрование определяемого вещества, рассчитывают содержание его по известным формулам ( см. книга 2, гл. При определении содержания сильных кислот и кислот средней силы в расчетах используют значение нормальности NaOH, установленной по метиловому оранжевому, а при определении слабых кислот - по фенолфталеину. [4]
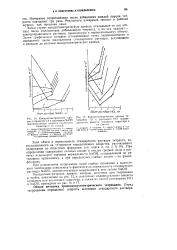 |
Кондуктометрические кри - [ IMAGE ] Кондуктометрические кривые ти-вые титрования 1 0 н. раствором NaOH трования 1 0 н. раствором НС1 индивидуальных веществ основного характера и их смесей. [5] |
Зная объем и нормальность стандартного раствора титранта, израсходованного на титрование определяемого вещества, рассчитывают содержание по известным формулам ( см. книга 2, гл. При определении содержания сильных кислот и кислот средней силы в расчетах используют значение нормальности NaOH, установленной по метиловому оранжевому, а при определении слабых кислот - по фенолфталеину. [6]
 |
Кривая фотометрического. [7] |
Таким образом, на нормальность стандартного раствора оказывают влияние и примеси карбонатов, и кислотность вещества, примененного для установки титра. Если титр стандартного раствора ( C4H9) 4NOH был установлен по слабой кислоте, а затем этот раствор использовался для титрования смесей, содержащих сильную и слабую кислоту, то для более сильной кислоты получают заниженные результаты, а для более слабой - завышенные, хотя общая кислотность смеси может быть определена правильно. Поэтому стандартный раствор ( C4Hg) 4NOH следует пропустить через ионообменную колонку, прежде чем применять для титрования фенолов ( см. гл. [8]
К - соответственно нормальность и поправочный коэффициент нормальности стандартного раствора титранта; Уг - объем раствора тиосульфата натрия, израсходованный на титрование, мл; VK, Va - соответственно общий объем и объем аликвотной порции анализируемого раствора, мл. [9]
Он служит, например, эталоном для установки нормальности стандартных растворов нитрата серебра и нитрата закисной ртути, применяется в биохимических исследованиях. [10]
Ег акв - грамм-эквивалентный нес стандартного вещества; N - нормальность стандартного раствора; Ь - израсходованный объем, мл. [11]
Навеску исследуемого раствора разбавляют водой так, чтобы нормальность его приблизительно равнялась нормальности стандартного раствора кислоты. [12]
С - объем стандартного раствора, пошедший на титрование образца, мл; N - нормальность стандартного раствора, г-экв / л; Е - эквивалентный вес соединения, содержащего гидроксил; М - молекулярный вес; V - алик-вотная доля запасного раствора, мл. [13]
С - вес образца; 6t - объем, необходимый для титрования растворителя и индикатора, мл; Ь - объем, пошедший на глухой опыт с салицилальдегидом, мл; N - нормальность стандартного раствора; 6 01 мг-экв X 100 для димс-тилгидразина, 3 205 мг-экв X 100 для гидразина. Используя двухступенчатое равновесие с кристаллическим фиолетовым в качестве индикатора, сумму оснований определяют при 590 им; причем конечную точку титрования устанавливают четче, чем по кривой титрования, наблюдаемой при 630 нм. Поскольку кристаллический фиолетовый в качестве индикатора дает нечеткую конечную точку ( данные различных авторов значительно отличаются), которая зависит от природы источника света, метод Малоуна включает значительно больше источников ошибок, чем метод Бернса и Лоулера. [14]
В тех случаях, когда титрование длится более 3 - 5 мин, возможны значительные потери вследствие летучести растворителя в титранте. Поэтому если поршень бюретки недостаточно хорошо пригнан, важно установить нормальность стандартного раствора обоими методами: и визуальным и по-тенциометрическим титрованием. [15]
Страницы: 1 2