Бериллий
Cтраница 1
Бериллий используют в качестве легирующей добавки к сплавам, придающей им повышенную коррозионную стойкость, высокую прочность и твердость. Наиболее ценны сплавы Си - Be ( бериллиевые бронзы), содержащие до 2 5 % Be. [1]
 |
Микроструктура алюминиевой бронзы с 10 5 % А1. X100. [2] |
Бериллий - дорогой и редкий металл, однако комплекс свойств втих бронз настолько высокий, что их производство экономически оправданно. [3]
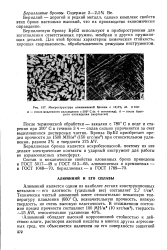 |
Микроструктура алюминиевой бронзы с 10 5 % Al. X100. [4] |
Бериллий - дорогой и редкий металл, однако комплекс свойств этих бронз настолько высокий, что их производство экономически оправданно. [5]
 |
Микроструктура кованой заготовки. [6] |
Бериллий в виде заготовок и готовых штамповок ( компактный материал) никакими токсическими свойствами не обладает и с ним можно обращаться как с любым обычным материалом. [7]
Бериллий, в бронзах 137 Бетон кислотоупорный 235 ел. [8]
Бериллий начинает экстрагироваться при рН 5 5; при рН в пределах 7 6 - 8 6 он имеет максимальную интенсивность флуоресценции. [9]
Бериллий ( VP - 1 85 в) имеет большое сродство к кислороду и потому стоек на воздухе даже при нагреве до 400 - 500 С. Стоек к концентрированной холодной азотной кислоте; в горячей кислоте разрушается. В соляной и плавиковой кислотах концентрированных и средних концентраций не стоек, так же как и в разбавленной серной кислоте. В концентрированной серной кислоте и концентрированных щелочах наблюдается сравнительно малая скорость разрушения. [10]
Бериллий, магний вместе с кальцием, стронцием, барием и радием составляют ПА-группу периодической системы. Все они, кроме бериллия, объединяются названием щелочноземельные металлы. Предпоследний электронный уровень атомов этих элементов является стабильным - от него электроны не отрываются. Валентными электронами являются наружные, по только в возбужденном состоянии атомов: в нормальном состоянии атомов два s - электрона имеют противоположные спины. Таким образом, обычно проявляемая этими элементами в соединениях валентность равна двум. Из всех этих элементов только один - бериллий - является моноизотопным, все остальные полиизотопны. Радий - единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа: вес его 14 изотопов радиоактивны, и среди них наиболее устойчив 226Ra, период полураспада которого составляет 1617 лет. [11]
Бериллий мало распространен в зем яой коре ( 0 0004 вес. [12]
Бериллий, как видно из рис. 1.33, в основном состоянии не имеет неспаренных электронов, поэтому его валентность равна нулю. [13]
Бериллий встречается в основном в виде редкого полудрагоценного минерала берилла ЗВеО - А12Оз - 6SiO2, содержащего обычно примесь Fe 3, которая придает минералу слабую зеленовато-голубую окраску. Интенсивно окрашенные разновидности берилла - драгоценный камень аквамарин и изумруд ( с примесью Сг 3) - самый дорогой после алмаза из драгоценных камней. Разработан метод получения искусственного изумруда при 15 ГПа и 1600 С. [14]
Бериллий проявляет склонность к комплексообразованию. Известно много сольватов солей Be с различными органическими растворителями. [15]
Страницы: 1 2 3 4