Двухвалентный бериллий
Cтраница 1
Двухвалентный бериллий был также использован для замещения кремния. При малых скоростях охлаждения расплава такого состава наблюдается образование нитевидных кристаллов амфибола. [1]
Однако экспериментально установлено, что обе связи в таких простых соединениях двухвалентного бериллия коллинеарны. Если мы хотим описывать каждую связь с помощью пары электронов, соединяющей два ядра, то одинаковые связи можно описать, только используя совершенно одинаковые орбитали атома бериллия. [2]
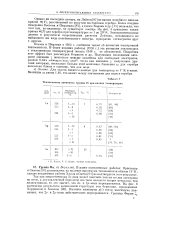 |
Теплоемкость элементов группы 1й при низких температурах. [3] |
Так как энергетическая 25-зона может вместить только по два электрона на атом, а двухвалентный бериллий все-таки является скорее металлом, чем диэлектриком, то это значит, что 2s - и 2 / ьзоны перекрываются. Наличие минимума g ( z) после максимума указывает, что 2s - и 2р - зоны действительно перекрываются. [4]
Сюда относятся четырехвалентный углерод, его ближайшие соседи по периодической системе: трехвалентный бор, двухвалентный бериллий, трехвалентный азот, а также двухвалентные платина и палладий и трехвалентное золото. [5]
Существование однофтористого бериллия BeF обнаружено только при изучении спектров. Устойчиво существуют только производные двухвалентного бериллия. Недавнее упоминание [ II о BeF3, невидимому, является опечаткой. [6]
 |
Теплоемкость элементи группы 16 при пмдкпх температурах. [7] |
Симона [ 9 - j ] указывалось на наличие максимума теплоемкости вблизи 11 К, однако позднейшие работы Хилла и Смита 1941 не подтвердили этот результат. Так как энергетическая 2.v - 3ona может вместить только по два электрона па атом, а двухвалентный бериллий все-таки является скорее металлом, чем диэлектриком, то это значит, что 2ts - и 2 / - зоны перекрываются. [8]
 |
Возможности гибридизации валентностей. [9] |
Гибридизация валентностей происходит всегда при переходе основного состояния s -, р - и с. Примером могут служить соединения трехвалентного бора BF3, B ( OH) 3, В ( СН3) 3и двухвалентного бериллия Ве ( С2Н6) 2, при образовании которых происходит переход из основных состояний атомов В и Be в Валентные с возникновением ( / - валентностей. [10]
При растворении электролитов в воде наблюдается явление электро-стрикции - кулоновские поля образующихся в растворе ионов взаимодействуют с диполями молекул воды достаточно сильно, вследствие чего вблизи ионов происходит сжатие растворителя, это подтверждается измерениями скорости ультразвука в таких водных системах. Структура воды при этом заметно искажается находящимися в ней ионами: ионы небольшого размера помещаются в пустотах надмолекулярных образований, ионы средних размеров ( например, одновалентные ионы щелочных металлов и ионы двухвалентного бериллия) имеют координационное число, равное четырем, и, очевидно, замещают молекулы воды в структурных узлах. Гидратированные ионы двухвалентных кальция и магния и трехвалентного алюминия могут быть представлены в виде октаэдров, в центре которых находятся ионы этих металлов, электростатически связанные с шестью молекулами воды, расположенными в их вершинах. Эти шесть молекул воды и составляют первую координационную сферу гидратированных многозарядных катионов. Отмеченное ион-дипольное взаимодействие наиболее характерно для гидратации катионов, при гидратации анионов со значительным зарядом или малым радиусом типично присоединение молекул воды за счет водородных связей. [11]
Поскольку - валентности дают особенно прочные атомные связи, при образовании соединений атомы используют всякую возможность для образования ( / - состояний. Гибридизация валентностей происходит всегда, когда при переходе из основного состояния в валентное одновременно происходит превращение атомных s -, р - и d - электронов в валентные электроны. Отсюда понятно, что трехвалентный бор [ в BFa, BC13, В ( ОН):, В ( СН3) ] и двухвалентный бериллий [ в Ве ( С2Н5) 2 ] также дают - валентности. [12]
Льюиса это вообще невозможно. Сила кислоты или основания, по Льюису, зависит от особенностей реакции. Это будет видно, если сравнить устойчивость комплексов двух положительных ионов различных металлов с одинаковыми лигандамк. Так, фторидный комплекс бериллия значительно устойчивее, чем такой же комплекс меди, откуда следует, что двухвалентный бериллий более кислотен, чем двухвалентная медь. Это слабое звено является самым большим недостатком теории Льюиса. [13]
Льюиса это вообще невозможно. Сила кислоты или основания, по Льюису, зависит от особенностей реакции. Это будет видно, если сравнить устойчивость комплексов двух положительных ионов различных металлов с одинаковыми лигандами. Так, фторидный комплекс бериллия значительно устойчивее, чем такой же комплекс меди, откуда следует, что двухвалентный бериллий более кислотен, чем двухвалентная медь. Это слабое звено является самым большим недостатком теории Льюиса. [14]
Еще более существенным недостатком этой теории является ее несостоятельность в решении вопроса о силе кислот. В то время как одно из преимуществ протонной теории заключается в возможности количественного определения относительной силы кислот и оснований, по теории Льюиса это вообще невозможно. Сила кислоты или основания, по Льюису, зависит от особенностей реакции. Это будет видно, если сравнить устойчивость комплексов двух положительных ионов различных металлов с одинаковыми лиган-дами. Так, фторидный комплекс бериллия значительно устойчивее, чем такой же комплекс меди, откуда следует, что двухвалентный бериллий более кислотен, чем двухвалентная медь. Это слабое звено является самым большим недостатком теории Льюиса. Есть и другие противоречия в отношении образования соединений. Если рассматривать кислотно-основную реакцию как процесс возникновения координационной ковалентной связи, то образование комплексного иона Cr ( NH3) e есть кислотно-основной процесс. Но с точки зрения феноменологических критериев Льюиса это не так, потому что скорость формирования комплекса мала, а должна быть большой. [15]
Страницы: 1 2