Область - фазовое равновесие
Cтраница 1
Область фазового равновесия, в которой существуют обе фазы, ограничена на фазовой диаграмме ( фиг. Левая ветвь ЕК этой кривой определяет удельный объем и жидкости, находящейся под давлением своего насыщенного пара в зависимости от величины давления р; правая ветвь KF - удельный объем v насыщенного пара. Обл асть слева от пограничной кривой соответствует жидкому состоянию вещества, а область справа - газообразному состоянию или перегретому пару. [1]
Как специалистам в области фазового равновесия, так и тем, кто только приступает к изучению данного вопроса, очевидным является многообразие принципов и методов оценки различных аспектов фазового равновесия. Лишь в очень редких случаях какой-либо один метод во всех отношениях превосходит другие. Это во многом затрудняет решение конкретных вопросов, но таково положение дел, из которого следует исходить. Тем не менее мы сочли возможным привести ряд рекомендаций, руководствуясь которыми можно, как правило, получить такие результаты, точность которых достаточна по крайней мере для начального этапа исследований. [2]
Наиболее широко и быстро развивающееся направление современных исследований в области фазовых равновесий можно выразить девизом, вынесенным на обложку международного журнала CALPHAD ( CALculation of PHAse Diagrams): Объединение фазовых диаграмм и термодинамики с помощью вычислительных машин. Важнейшей составной частью этого направления являются расчеты равновесных диаграмм состояния по известным термодинамическим функциям фаз, в том числе и на основе модельных подходов. [3]
Рассмотрим более подробно без соблюдения масштабов фазовую ро-диа-грамму вещества, в которой области фазового равновесия изображаются площадями. На диаграмме площадь / представляет собой твердую фазу, площадь / / изображает двухфазную систему, состоящую из жидкой и твердой фаз, площадь / / / представляет собой жидкую фазу, площадь IV - область жидкой и газообразной фаз, площадь V - область газообразного состояния тела, а площадь VI - область твердой и газообразной фаз. [4]
Перенесение ряда закономерностей, выявленных для низкомолекулярных веществ, на высокомолекулярные соединения с учетом, конечно, специфики последних особенно справедливо для области фазовых равновесий, как это было ранее показано, в частности, для систем полимер - растворитель. Поэтому вполне оправданной, на наш взгляд, является первая, как бы вводная, глава настоящей монографии, в которой даются основные понятия о жидких кристаллах вообще на примере низкомолекулярных соединений. [5]
Последняя модификация аппаратуры высокого давления, представляющая значительный интерес для материаловедения, состоит в использовании газообразного кислорода при давлении 4 кбар для исследований в области фазовых равновесий. Основное новое введение связано с тем, что обычные гидротермальные камеры с холодным уплотнением и вспомогательное оборудование могут содержать кислород при умеренных температурах без чрезмерной коррозии. Стеллитовые сосуды давления используются в сочетании с клапанами, фитингами и манометрами Бур дона из нержавеющей стали при температурах до 750 и парциальных давлениях кислорода до 4 кбар. Исследуемые образцы просто заворачиваются в золотую фольгу для предотвращения их взаимодействия со стенками сосуда. Высокое давление кислорода достигается с помощью бустерного насоса из нержавеющей стали. [6]
В заключение нужно еще раз подчеркнуть, что главное не в спорах о терминологии, а в том, что новая, до сего времени неизвестная область фазовых равновесий экспериментально обнаружена и исследована. Что же касается названия, то, с нашей точки зрения, наименование равновесие, газ - газ вполне законно. Можно называть это явление равновесием флюид - флюид, вспомнив еще раз об уточнении по давлению, температуре и положению на фазовой диаграмме. Но безусловно нельзя называть его равновесием жидкость - газ. [7]
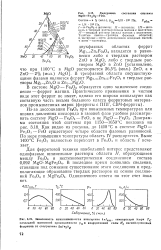 |
Зависимость намагничен гост и насыщения 4я / нас, температуры Кюри Tg начальной магнитной проницаемости 1Д и коэрцитивной силы Hf магний - Н. ннковцх ферритов от содержания ZnFejO. [8] |
Из-за диссоциации Fe203 при повышенных температурах или низких давлениях кислорода в газовой фазе удобнее рассматривать систему MgO - Fe2O3 - FeO, а не MgO - Fe203, Диаграмма состояния этой системы при 1150 - 1650 С показана на рис. 3.18. Как видно из рисунка, до 1400 С в системе MgO - Fe2O3 - FeO существуют четыре области фазовых равновесий. По мере повышения температуры область IV расширяется. Выше 1400 С Fe203 полностью переходит в Fe3O4 и область / исчезает. [9]
Основоположником теории физико-химического анализа гетерогенных систем является Гиббс, сформулировавший в 1874 г. правило фаз. Идеи Гиббса в области фазовых равновесий нашли практическое применение в работах Ле-Шателье, Вант-Гоффа, Розебома, Скрейнема-керса, Ван-Лаара, Д. П. Коновалова, И. Ф. Шредера, В. Ф. Алексеева, Г. А. Таммана и других ученых. Выдающаяся роль в разработке теории и экспериментального применения физико-химического анализа при исследовании гетерогенных систем принадлежит акад. Курнакова), позволяющий производить автоматическую запись термограмм. [10]
Если записать выражения AG ( vj для аморфной, кристаллической и жидко-кристаллической фаз, то при каждой данной концентрации более выгодно то состояние, для которого значение свободной энергии минимально. Если же кривые для разных фаз пересекаются, то происходит переход из одной фазы в другую4 и в некоторой области концентраций обе фазы сосуществуют в равновесии. В области фазового равновесия концентрации полимера в каждой фазе не меняются, а меняется соотношение фаз. [11]
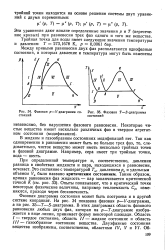 |
Фазовая р - V-диаграмма со - [ IMAGE ] Фазовая Т - S-диаграмма стояний состояний. [12] |
Фазовая диаграмма состояния может быть построена и в другой системе координат. На рис. 34 показана фазовая р - У-диаграмма, а на рис. 35 - - Т-5-диаграмма. В этих диаграммах область фазового равновесия любых двух фаз, которая на р - Г - диаграмме изображается в виде линии, принимает форму некоторой площади. [13]
Если выбором процесса проблему совместимости решить нельзя, используют спец. Такими барьерами являются, напр. На диаграммах состояния в этом случае критические точки областей фазового равновесия значительно сдвигаются. Сдвиг этот обусловлен существенным влиянием поверхностной энергии на общую свободную энергию взаимодействия фаз. Так, у нек-рых углеродных материалов с высокодисперсным фрагментарным строением дополнительная энергия составляет несколько килокалорий на моль, что может способствовать снижению т-ры образования эвтектик в контакте с жидкими карбидообразующими металлами ( никелем, цирконием и др.) на несколько десятков и даже сотен градусов в ряду пирографит - углерод - кокс. Эффективным средством борьбы с подобным явлением служит пассивирование поверхности углеродного материала нанесением тонкого слоя атомарного пироуглерода из газовой фазы. Чтобы подавить рост нежелательных фаз, используют также термокинетические факторы. Материалы после пассивирования поверхности пригодны для последующей эксплуатации в ограниченных температурно-временных условиях. [14]
Если записать выражения AC ( v -) для аморфной, кристаллической и жидко-кристаллической фаз, то при каждой данной концентрации более выгодно то состояние, для которого значение свободной энергии минимально. Если же кривые для разных фаз пересекаются, то происходит переход из одной фазы в другую и в некоторой области концентраций обе фазы сосуществуют в равновесии. Если при этом касательная лежит ниже обеих кривых, то в данной области концентраций равновесие фаз оказывается выгодней, чем любое из состояний, причем концентрация полимера в каждой фазе равна концентрации в соответствующей точке касания. В области фазового равновесия концентрации полимера в каждой фазе не меняются, а меняется соотношение фаз. [15]
Страницы: 1 2