Область - двухфазное состояние
Cтраница 3
При изменении состава смеси фазовая диаграмма и область двухфазного состояния на диаграмме давление - температура сдвигаются в ту или иную сторону. [31]
Критическое давление и температура являются максимальными для области двухфазного состояния. В критической точке К удельная теплота парообразования г обращается в ноль. Это следует из уравнения ( 172) Клапейрона - Клаузиуса, так как в точке К и v, a dp / ( IT не может быть бесконечно большой величиной. [32]
При давлениях, больших критического, отсутствует область двухфазного состояния. Вещество находится либо в жидком, либо в газообразном состоянии. Границей между ними служит критическая изотерма. [33]
Из уравнения (1.286) следует, что в области двухфазного состояния вещества, где ср со, а. Таким образом, значительно большее охлаждение газа и независимость а от вида уравнения состояния газа является основным преимуществом методов Клода и Капицы перед методом Линде. [34]
Из рис. 1 - 18 видно, что область двухфазного состояния в интервале температур от 31 1 до 41 С для этого состава смеси является областью обратной конденсации. [35]
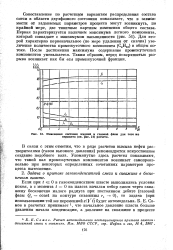 |
Изменения составов жидкой и газовой фазы для того же варианта ( 51 расчета. [36] |
Сопоставление по расчетным вариантам распределения состава смеси в области двухфазного состояния показывает, что в зависимости от задаваемых параметров процесса могут возникнуть, по крайней мере, две типичные картины изменения общего состава. Для второй характерно первоначальное ( по мере удаления от скачка) увеличение количества промежуточного компонента ( С4Н10) в общем потоке. После достижения максимума содержание промежуточных компонентов уменьшается. Таким образом, перед поверхностью разрыва возникает как бы вал промежуточной фракции. [37]
Из этого следует, что в той части области двухфазных состояний, где сж0, изоэнтропы проходят более круто, чем линии постоянной сухости х const, и, в частности, круче правой пограничной кривой ( рис. 6 - 40), так что изоэнтропа, проведенная из области перегретого пара, может пересекать правую пограничную кривую. Там, где сж0, наклон изоэнтроп меньше, чем у линии % const и правой пограничной кривой, и поэтому любая адиабата, начинающаяся в области перегретого пара, не пересекается с правой пограничной кривой и по мере увеличения объема все более удаляется от нее. В точке правой пограничной кривой, в которой теплоемкость насыщенного пара с обращается в нуль, изоэнтропа касается пограничной кривой. Изоэнтропа, проведенная из точки жидкого состояния вещества, по мере увеличения объема приближается к левой пограничной кривой, пересекается с ней и затем удаляется от нее в область двухфазного состояния вещества. [38]
Из этого следует, что в той части области двухфазных состояний, где сх 0, изоэнтропы проходят более круто, чем линии постоянной степени сухости х const и, в частности, круче правой пограничной кривой ( фиг. Там, где сх 0, наклон изоэнтроп меньше, чем у линии х const и правой пограничной кривой, и поэтому адиабата, проведенная из области перегретого пара, не пересекается с правой пограничной кривой и по мере увеличения объема все более удаляется от нее. [39]
Кроме того, наносится пограничная кривая, а в области двухфазного состояния Е1ещества жидкость-пар проводятся линии постоянного паросодержания. [40]
Гб - диаграмме, наносятся пограничные кривые и в области двухфазного состояния жидкость - насыщенный пар - линии постоянного паросодержания. [41]
Нижняя изобара р - ртр своим прямолинейным участком разграничивает области равновесных двухфазных состояний жидкость-газ и твердое тело-газ. В случае, когда за точку начала отсчета энтальпии и энтропии принимают тройную точку ( как, например, для воды), эта изобара проходит через начало координат. [42]
Кроме того, наносится пограничная кривая, а в области двухфазного состояния вещества жидкость - пар проводятся линии постоянного паросодержания. [43]
Крайняя нижняя изобара р ртр своим прямолинейным участком разграничивает области равновесных двухфазных состояний насыщенный пар - жидкость и твердое тело - насыщенный пар. В случае, когда за точку начала отсчета энтальпии и энтропии принимают состояние тройной точки ( как, например, для Н2О), эта изобара проходит через начало координат. [44]
 |
Схема, иллюстрирующая эффект Ариса. Пояснения в тексте. [45] |
Страницы: 1 2 3 4