Область - электрохимическая устойчивость
Cтраница 1
Область электрохимической устойчивости определяется материалом электродов. [1]
Граничные величины потенциалов области электрохимической устойчивости электролита определяются в основном тремя видами электрохимических реакций: 1 - разряд катионов и анионов фона; 2 - электрохимическое растворение анодного материала; 3 - электрохимическое разложение самого растворителя. [2]
Они характеризуют катодные границы областей электрохимической устойчивости окислов титана в кислом растворе. [3]
Поэтому эта область называется областью электрохимической устойчивости воды. [4]
Величины граничных потенциалов, определяющих область электрохимической устойчивости для наиболее употребительных неводных растворителей, приведены в табл. 12 приложения. [5]
Кроме природы и состава раствора, на область электрохимической устойчивости сильно влияют природа и состояние поверхности электрода. Например, нитрилы с низкими молекулярными массами, в первую очередь АН, с большим трудом окисляются и восстанавливаются электрохимически на обычно применяемых электродах. В АН-растворах тетраалкиламмонийных солей обычно предлагается, что катодные границы стабильности электролита определяются восстановлением катиона. Для ртутного электрода имеются прямые доказательства этого предположения - образование амальгамы тетраалкиламмония. [6]
Область потенциалов, заключенная между этими линиями, является областью электрохимической устойчивости воды. Область, лежащая ниже линии ab равновесных потенциалов водородного электрода, соответствует зоне разложения воды с выделением водорода. Область же, расположенная выше линии cd равновесных потенциалов кислородного электрода, соответствует зоне разложения воды с выделением кислорода. [7]
Хотя диаграмма эта охватывает растворы кислот и щелочей, рассуждения о равновесных потенциалах и о протекании реакций относятся только к водороду и кислороду. Таким образом, диаграмма представляет область электрохимической устойчивости воды в кислых, нейтральных и щелочных растворах. [8]
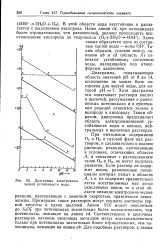 |
Диаграмма электрохими ческой устойчивости воды. [9] |
Хотя диаграмма эта охватывает растворы кислот и щелочей, рассуждения о равновесных потенциалах и о протекании реакций относятся только к водороду и кислороду. Таким образом, диаграмма представляет область электрохимической устойчивости воды в кислых, нейтральных и щелочных растворах. При ничтожном содержании О2 и Н2 в газовой фазе над раствором, и следовательно в водном растворе, реакции, протекающие в условиях, отвечающих области Л, и связанные с расходованием газов О2 и Н2, не могут получить развития. [10]
 |
Диаграмма электрохимической устойчивости воды.| Нормальный элемент Вестона. [11] |
Выше линии cd, когда потенциал более положителен, чем равновесный потенциал кислородного электрода, на электроде будет идти процесс выделения кислорода. В области А между линиями cd и ab может иметь место только окисление водорода и восстановление кислорода, а разложения воды. Поэтому эта область называется областью электрохимической устойчивости воды. [12]
Наиболее важным свойством растворителя, определяющим возможность его применения в электрохимической технологии, является электрохимическая устойчивость. Если осаждение металла происходит при потенциалах более отрицательных, чем потенциал разряда ионов гидроксония или молекул воды, то процесс его выделения сопровождается параллельной реакцией выделения водорода. По этой причине металлы, обладающие достаточно отрицательными стандартными потенциалами, не могут быть выделены из водных растворов. Единственным электродным процессом является выделение водорода, обычно при этом происходит подщела-чивание приэлектродного слоя и выпадение осадка гидроокисей металла либо осаждение окисла металла на поверхности катода. Аналогичные процессы могут протекать и в органических протонных растворителях, образующих в результате диссоциации ионы водорода. Поэтому в качестве растворителей желательно использовать органические апротон-ные растворители, которые не содержат подвижного атома водорода. Апротонные органические растворители имеют чрезвычайно высокую электрохимическую устойчивость и не восстанавливаются до потенциалов - 3 0 - 1 - 3 5 В, а их анодное окисление близко к l 0 - f - 1 5 В. Область электрохимической устойчивости определяется материалом электрода, природой органического растворителя и растворенной соли. [13]
Страницы: 1