Оболочка - вода
Cтраница 2
Если наряду с электрострикцией могут играть роль и другие причины, то все же все наблюления и соображения приводят к заключению, что ионы окружены оболочкой воды. Высказанное нами ранее допущение о гидратации находится с этим в полном согласии; однако следовало бы, может быть, делать различие между химической гидратацией, которая затрагивает лишь несколько молекул воды, и электростатический притяжением, которое действует на всю оболочку воды. [16]
Для обозначения такой степени защиты применяются условные буквы IP. Следующие за ними две цифры обозначают: первая ( табл. 4) - степень защиты персонала от соприкосновения с токоведущими или движущимися частями, расположенными внутри оболочки, а также степень защиты встроенных в оболочку элементов оборудования от попадания внутрь твердых посторонних тел; вторая ( табл. 5) - степень защиты оборудования от проникновения внутрь оболочки воды. [17]
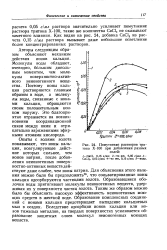 |
Помутнение растворов тритона Х-100 при добавлении разных солей. [18] |
Опыты с золями золота показывают, что ионы кальция, коагулирующее действие которых сильнее, чем ионов натрия, после добавления неионогенных поверхностно-активных веществ действуют даже слабее, чем ионы натрия. Для объяснения этого явления можно было бы предположить10, что сольватированные ионы кальция адсорбируются частицами золота. Образовавшиеся оболочки воды притягивают молекулы неионогенных веществ, удерживая их у поверхности частиц золота. [19]
Вбрызгиваемая в узком сечении разбавленная фосфорная кислота в расширяющейся части трубы Вентури образует влажную завесу, которая действует как преграда. Пройдя через завесу газ насыщается влагой. Частички, окруженные оболочкой воды, утяжеляются и могут поэтому в дальнейшем легко отделяться от газовой фазы. Выделение жидкой фазы из газового потока производится частично в переходной трубе из скруббера Вентури и, в основном, в циклоне. [20]
Мембранная оболочка имеет толщину - 100 мкм и состоит из плотной активной части ( толщиной 0 2 - 1 0 мкм), где, собственно, и происходят осмотические явления, а также пористой основы. Диаметр пор в активной части составляет 0 02 - 0 05 мкм. При пропускании через такие оболочки воды [ под давлением ( 30 - т - 50) 105 Па ] ее молекулы диффундируют через поры, а молекулы примесей задерживаются. Производительность очистки мала и составляет всего 1 л / сут с 1 м2 поверхности оболочки. [21]
Перед началом эксперимента защитная оболочка длительно продувалась паром. В результате температура стенок оболочки была стабилизирована на уровне 147 С при атмосферном давлении внутри нее. Экспериментальное исследование было выполнено при постоянных параметрах поступающей в оболочку воды: давление 100 кгс / см2 и температура 210 С. [22]
Возможность стабилизации глины в стволе скважины обусловлена состоянием воды в составе бурового раствора. Поэтому, например, электролиты, в случае высоких концентраций, разрушая гелевую оболочку воды на глине, будут уменьшать содержание также и гидратной воды, Гидратная вода инертна к ионно-молекулярной воде, поэтому при большой концентрации электролита между частицами глины возникает гидрофобное взаимодействие. Это препятствует ее набуханию и диспергированию. Гидрофобные взаимодействия будут обусловлены именно тем, что вода гидратной оболочки неполярна, а образование химической связи ( донорно-акцепторной) будет идти с индукционным периодом. [23]
Стабильность золей обусловлена, как мы видели, зарядами адсорбированных ионов Снятие этих зарядов вызывает коагуляцию. В растворах лиофильных коллоидов прибавляется новый фактор, который чаете имеет решающее значение: защита от коагуляции оболочкой воды, окружающей мицеллу. Чтобы вызвать коагуляцию лиофильных коллоидов в виде плотногс осадка, необходимо не только снять заряд с коллоидальных частиц, но еще их дегидратировать. Без дегидратации раствор постепенно застывает в гель. [24]
Различия в прочности коагуляционных структур у водных суспензий модифицированного монтмориллонита с различными катионами в обменном комплексе указывают на то, что дисперсионная среда связывается поверхностью минерала по-разному. Катион натрия весьма способствует значительному диспергированию частиц монтмориллонита, снижая концентрацию дисперсной фазы, необходимую для образования пространственной сетки, в несколько раз. Fe-ионы способствуют образованию плотной и компактной оболочки воды вокруг частиц глинистого минерала. Взаимодействие между частицами происходит на более близком расстоянии, что благоприятствует связыванию отдельных частиц в крупные агрегаты. Это приводит к получению прочной коагуляционной структуры суспензий Fe-форм и значительному повышению устойчивости их к действию электролитов. [25]
При тепловом движении молекул воды коллоидные частицы воспринимают их воздействие и вовлекаются в молекулярно-кинети-ческое ( броуновское) движение, при котором вместе с коллоидной частицей движется двойной электрический слой с частью противоионов диффузного слоя, содержащихся в оболочке воды. Остальные противоионы отрываются от движущейся частицы, оставаясь во внешней части - - за границей скольжения. Значение - потенциала зависит от числа противоионов, увлекаемых частицей; с увеличением числа противоионов - потенциал уменьшается. Рост концентрации противоионов в растворе должен приводить к увеличению их концентрации в оболочке воды, окружающей частицу, и, следовательно, к снижению - потенциала. В пределе повышение концентрации противоионов может привести к перезарядке частицы, т.е. к изменению знака заряда. Экспериментально значение электрокинетического потенциала определяют методом электрофореза. [26]
При этом в оболочку было подано 100 кг воды. В результате этого в ней установилось новое давление, равное 0 68 МПа; максимальное расчетное давление при этих же условиях 0 665 МПа, что свидетельствует о хорошем совпадении результатов эксперимента и расчета. Анализ результатов расчета показал, что в первые примерно 0 18 с происходит резкое падение давления и температуры среды в оболочке до значений равных соответственно 0 092 МПа и 97 С, т.е. первоначальное падение температуры составило по расчету 50 С. Это падение начальных параметров среды связано с затратой части ее энергии на испарение поступающей в оболочку воды. [28]
 |
Влияние ионов на структуру воды. [29] |
Возвращаясь к вопросу, в какой степени такое явление, как высаливание, можно приписать непосредственно влиянию солей на структуру воды, необходимо подчеркнуть важность установления внутренне непротиворечивой причинно-следственной связи между этими явлениями, которая сохраняется в широком ряду солей. Следует избегать искушения давать объяснения, основанные на констатации post facto, которые можно легко построить почти в любом случае для небольшого числа солей. Так, более слабое высаливание под действием больших анионов по сравнению с малыми структурирующими ионами в той же концентрации можно приписать деструктурирующему эффекту больших ионов, которые, разрушая структуру воды, облегчают внесение неполярных молекул в раствор. Увеличение структурированности воды в присутствии такого иона или при добавлении относительно неполярных веществ, таких, как спирт или диоксан, должно облегчить образование оболочки структурированной воды вокруг неполярной молекулы, которая может делить структурированный слой воды с ионом или органическим компонентом раствора. Но это объяснение предполагает противоположное предыдущему влияние на структуру воды, а также сталкивается с некоторыми трудностями в случае иона тетраметиламмония. [30]
Страницы: 1 2 3
