Оболочка - благородный газ
Cтраница 1
 |
Потенциалы ионизации элементов в зависимости от их порядкового номера 2 в таблице Менделеева. [1] |
Оболочка благородных газов заполнена и поэтому наиболее прочна. [2]
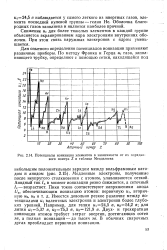 |
Потенциалы ионизации элементов в зависимости от их порядкового номера Z в таблице Менделеева. [3] |
Оболочка благородных газов заполнена и является наиболее прочной. [4]
Вокруг атома железа создается устойчивая Зб-электронная оболочка благородного газа ( криптона), обусловливающая большую прочность соединения. Такие же связи существуют в молекулах всех циклопентадиенильных и бензольных производных других переходных металлов. Атомы металлов в молекулах этих веществ находятся в таком же состоянии, как атом железа в гексацианоферрат-ионе. [5]
Вокруг атома железа создается устойчивая 36-электронная оболочка благородного газа ( криптона), обусловливающая большую прочность соединения. Такие же связи существуют в молекулах всех циклопентадиенильных и бензольных производных других переходных металлов. Атомы металлов в молекулах этих веществ находятся в таком же состоянии, как атом железа в гексацианоферрат-ионе. [6]
Так как атом стремится дополнить свою электронную оболочку до оболочки ближайшего благородного газа, то неметаллы кристаллизуются так, чтобы число соседей равнялось 8 - N, где N номер группы Периодической системы, к которой принадлежит данный элемент. Так, селен и теллур ( группа VI) образуют кристаллические структуры со спиральными цепочками, где координационное число равно двум, а в структурах мышьяка, сурьмы и висмута ( группа V) координационное число равно трем. [7]
Приведите формулы некоторых простых карбонилат-ионов и карбонилгидри-дов, Имеют ли они завершенную оболочку благородного газа. [8]
В свою очередь присоединение одного лишнего электрона к атому хлора превращает его электронную оболочку в оболочку благородного газа - на этот раз аргона ( стр. Оболочка иона С1 - тоже очень устойчива. [9]
Наличие заполненных предвнешних ( п -) d - и ( п - 2) / - уровней сверх оболочки предыдущего благородного газа накладывает отпечаток на свойства элементов подгруппы мышьяка. [10]
Следовательно, у них, так же, как и у атома водорода, не хватает одного электрона до завершения оболочки благородного газа. Поэтому галогены сильно электроотрицательны и очень реакционноспособмы как окислители, вследствие чего в свободном состоянии не встречаются в природе. Легко соединяясь с металлами, образуют соли - галогениды. Астат вообще не встречается в природе и получен искусственно в малых количествах. Присоединяя по одному электрону, галогены превращаются в На1 - - ионы. В таком состоянии они находятся в галогенидах. [11]
Что же касается ионов щелочных элементов, то, как следует из табл. I, строение их электронных оболочек сходно со строением оболочек благородных газов, - они характеризуются заполненными s - к р-подоболочками. Соответственное сходство проявляется и в спектрах; благодаря большой устойчивости замкнутых электронных оболочек резонансные линии ионов щелочных элементов расположены в далеком ультрафиолете. [12]
У атомов галогенов находится по семь электронов во внешнем уровне - saps - Следовательно, у них, так же как и у атома водорода, не хватает одного электрона до завершения оболочки благородного газа. Поэтому галогены сильно электроотрицательны и очень реакци-онноспособны как окислители, вследствие чего в свободном состоянии не встречаются в природе. Легко соединяясь с металлами, образуют соли - галиды. Астат вообще не встречается в природе и получен искусственно в малых количествах. В таком состоянии они находятся в галидах. В их молекулах атомы соединены единичными ковалентными связями. [13]
Так, у водорода до завершенной внешней оболочки благородного газа гелия недостает одного электрона. То же самое наблюдается у галогенов, у которых до образования оболочки соответствующего благородного газа тоже недостает одного электрона. [14]
Так, у водорода до завершенной внешней оболочки благородного газа гелия не достает одного электрона. То же самое наблюдается у галогенов, у которых до образования оболочки соответствующего благородного газа тоже не достает одного электрона. [15]
Страницы: 1 2