Электронная оболочка - атом - кислород
Cтраница 1
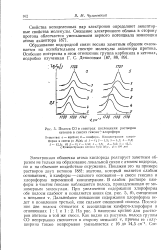 |
Полоса СО в спектрах поглощения растворов кетонов в смесях гексан - f - хлороформ. [1] |
Электронная оболочка атома кислорода реагирует заметным образом не только на образование локальной связи с атомом водорода, но и на объемное воздействие окружения. Покажем это на примере растворов двух кетонов [88]: ацетона, который является слабым основанием, и камфоры - сильного основания-в смеси гексана и хлороформа переменной концентрации. В слабом растворе камфоры в чистом гексане наблюдается полоса, принадлежащая ее мономерным молекулам. Дальнейшее повышение содержания хлороформа ведет к появлению третьей, еще сильнее смещенной полосы. На рис. 5 нанесены кривые для растворов ацетона в той же смеси. [2]
В этом случае меняется электронная оболочка атома кислорода, не входящего в главную сопряженную систему, поэтому окраска не углубляется. [3]
Расположение точек показывает, что в электронной оболочке атома кислорода имеются две пары спаренных электронов и два валентных холостых электрона. [4]
И в том, и в другом случаях водородной связью затрагивается электронная оболочка атома кислорода, расположенного достаточно близко к асимметричной атомной группировке ментола. Поэтому изменение равновесия диссоциированных и ассоциированных водородных связей при стекловании должно сказываться на наблюдаемой оптической активности весьма сильно. [5]
 |
Проекция структуры афвиллита на плоскость ( 010. [6] |
О наличии донорно-акцепторных связей в анионах 03SiOH3 - говорит также повышенная диффузность электронных оболочек атомов кислорода [ О - и О ( Н) 1: значения Ne для этих атомов оказались близкими к 6.2 вместо Ne8 для нейтрального атома кислорода. [7]
Более высокая окислительная способность оксокислот по сравнению с их солями объясняется сильным поляризующим действием ионов водорода на электронную оболочку атома кислорода, что уменьшает прочность связи Э - О и тем самым снижает устойчивость молекулы кислоты. [8]
Электронная оболочка атома кислорода состоит из двух внутренних и шести внешних электронов. Проявление иного валентного состояния связано с переходом электронов на орбиту с более высоким главным квантовым числом. [9]
Из схем следует, что в атоме кислорода из шести внешних электронов одиночными являются два, а в атоме натрия - один внешний электрон. Электронная оболочка атома кислорода состоит из двух уровней, а атома натрия - из трех. [10]
Расстояния между двумя атомами кислорода и водородной связи О - Н О обычно значительно меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Следовательно, должно быть значительное взаимное отталкивание электронных оболочек атомов кислорода. Однако силы отталкивания преодолеваются силой водородной связи. [11]
Атом кислорода невелик, его радиус меньше радиусов атомов углерода и азота; однако настоящие фазы внедрения кислорода - только твердые растворы и низшие окислы переходных металлов. В силицидах и боридах фактором, препятствующим образованию фаз внедрения, является большой атомный радиус, в окислах такой фактор - электронная структура атома кислорода. Электронная оболочка атома кислорода Is22s22p4 имеет два неспаренных электрона. Кислород подчиняется правилу октета, и завершенная электронная структура может быть получена путем приобретения двух электронов. Поэтому у кислорода донорная способность ослаблена склонностью к поглощению электронов. [12]
Атом кислорода невелик, его радиус меньше радиусов атомов углерода и азота; однако настоящие фазы внедрения кислорода - только твердые растворы и низшие окислы переходных металлов. В силицидах и боридах фактором, препятствующим образованию фаз внедрения, является большой атомный радиус, в окислах такой фактор - электронная структура атома кислорода. Электронная оболочка атома кислорода Is22s22p4 имеет два неспаренных электрона. Кислород подчиняется правилу октета, и завершенная электронная структура может быть получена путем приобретения двух электронов. Поэтому у кислорода донорная способность ослаблена склонностью к поглощению электронов. [13]
 |
Уровни энергии МО лиганда ( Л и АО металла ( М и электронные переходы в комплексах. [14] |
Так, цвет 2-гидрокси - 1-нитрозонафталина, существующего в хиноеоксимной таутомерией форме ( 78), углубляется от оранжево-красного до зеленого при комплексообразовании с соединениями железа, до оливкового - с соединениями хрома, до красно-коричневого - с соединениями кобальта. Цвет Ализарина ( 79) углубляется от желтого до красного при комплексообразовании с соединениями алюминия, до коричневого-с соединениями хрома, до фиолетового - с соединениями железа. Здесь Комплексообразование также изменяет электронную оболочку атома кислорода, входящего в сопряженную систему, что и является причиной углубления окраски. [15]
Страницы: 1 2