Внешняя оболочка - молекула
Cтраница 1
Внешняя оболочка молекулы, электроны которой осуществляют химическую связь между атомами, имеет вполне определенную форму. Порядок соединения атомов в сложных молекулах обычно указывают в структурных химических формулах. [1]
Наличие во внешней оболочке молекулы неподеленных пар электронов в некоторых случаях также может оказывать влияние на энергию активации. Например, в реакции HC1 D - H C1D при взаимодействии атома с молекулой существенную роль должны играть неподеленные р-электроны атома хлора. Заметим, что, согласно расчетам Маги [898], выполненным при помощи полуэмпирического метода, активированный комплекс H... D имеет трехугольное строение. [2]
При сближении молекул между собой электроны, находящиеся во внешних оболочках молекул, взаимодействуют двояким образом. В зависимости от этого между молекулами возникает притяжение или отталкивание или, иначе говоря, возникает симметричное или антисимметричное движение электронов. Симметричное состояние для атомов водорода означает притяжение атомов, а антисимметричное, наоборот, отталкивание их друг от друга. При антисимметричном состоянии движения спины электронов должны быть параллельными. Следовательно, силы отталкивания возникают в результате взаимодействия внешних электронных оболочек и зависят от особенностей этих оболочек. [3]
Свойства 0 - и я-орбит позволяют приближенно рассматривать поведение я-электронов независимо от поведения а-электронов; я-электро-ны как бы образуют внешнюю оболочку молекулы и двигаются в поле атомных остовов, экранированных более прочно связанными 0 - электронами. Свойства а-связей в молекулах с сопряженными и несопряженными связями одинаковы и особенности поведения молекул с сопряженными связями определяются особенностями делокализованных я-орбит. [4]
Свойства а - и я-орбит позволяют приближенно рассматривать поведение я-электронов независимо от поведения о-электронов; я-элек-троны как бы образуют внешнюю оболочку молекулы и двигаются в: поле атомных остовов, экранированных более прочно связанными а-электроиами. Свойства о-связей в молекулах с сопряженными и несопряженными связями одинаковы и особенности поведения молекул с сопряженными связями определяются особенностями делокализоеанных я-орбит. [5]
Свойства а - и я-орбит позволяют приближенно рассматривать поведение я-электронов независимо от поведения а-электронов; я-элек-троны как бы образуют внешнюю оболочку молекулы и двигаются в. Свойства о-связей в молекулах с сопряженными и несопряженными связями одинаковы и особенности поведения молекул с сопряженными связями определяются особенностями делокализованных я-орбит. [6]
Для неспецифических ( по классификации А. В. Киселева [ 41) адсорбентов энергия взаимодействия с молекулами адсор-батов в основном обусловлена дисперсионными силами, величина которых зависит от общих поляризуемости и числа электронов на внешних оболочках молекул, их строения и ориентации относительно поверхности. [7]
Существенную роль играет и то, что внешнюю оболочку молекул алканов образуют атомы водорода и именно их легче оторвать атакующему радикалу. [8]
Таким образом, молекулы ковалентных соединений имеют строго постоянную структуру. Положение каждого атома в них закреплено по отношению к другим атомам. Внешняя оболочка молекулы, электроны которой осуществляют химическую связь между атомами, имеет вполне определенную форму. [9]
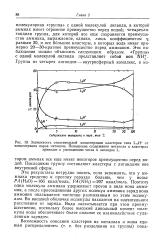 |
Зависимость относительной концентрации кластеров типа LnH от. [10] |
Эти результаты нетрудно понять, если вспомнить, что у аммиака сродство к протону гораздо больше, чем у воды: РЛ ( Н2О) 166 ккал / моль, / M ( NH3) 207 ккал / моль. Поэтому одна молекула аммиака удерживает протон в виде иона аммония, а после присоединения других молекул аммиака заряд иона аммония оказывается частично размазанным по этим молекулам. Во внешней оболочке молекулы находятся на значительном расстоянии от заряда. Вода захватывается при этом преимущественно, поскольку более высокий дипольный момент молекулы воды обеспечивает более сильное ее взаимодействие с удаленным зарядом. [11]
В диэлектриках предполагается иная природа сил отталкивания. Согласно квантовой теории, природа сил отталкивания коренится в электромагнитном строении материи. При сближении молекул между собой электроны, находящиеся во внешних оболочках молекул, взаимодействуют двояким образом. В зависимости от этого между молекулами возникает притяжение или отталкивание, или, иначе говоря, возникает симметричное или антисимметричное движение электронов. Симметричное состояние для атомов водорода означает притяжение атомов, а антисимметричное, наоборот, отталкивание их друг от друга. [12]
Все дело в том, что уровни энергии изолированных атомов при их объединении в молекулу не остаются неизменными. В результате в этих атомах при образовании молекулы замкнутая подоболочка с / 0 разрушается. Более того, все электроны внешней оболочки оказываются обладающими примерно одинаковыми энергиями, так что заполнение одноэлектронных состояний во внешней оболочке молекулы отличается от заполнения ее в изолированных атомах. Некоторые особенности этого процесса мы обсудим ниже. [13]
Молекулы газа могут поглощать энергию различными путями. Во-первых, каждая молекула в газовом состоянии обладает энергией поступательного движения. Во-вторых, она может обладать энергией колебания, вращения и электронного возбуждения; последняя представляет энергию, приобретаемую одним или несколькими электронами, образующими внешнюю оболочку молекулы. [14]
Если все атомы водорода в цепи замещены на фтор или хлор, как в случае ПХТФЭ и ПТФЭ, полимерные цепи принимают спиральную кон-формацию. Так, Банн и Хауэл 191 показали, что в результате закручивания углерод-углеродной цепи ПТФЭ образуется почти идеальный цилиндр с внешней оболочкой из атомов фтора. Поразительную химическую стойкость и низкую плотность энергии когезии этого полимера и объясняют наличием такого инертного, полностью фторированного внешнего слоя. Слабое межмолекулярное взаимодействие, обусловленное наличием фторированной внешней оболочки молекулы, и жесткая стержнеоб-разная конфигурация, обусловленная спиральной формой молекулы, облегчают скольжение цепей относительно друг друга. Именно этими причинами объясняется низкий коэффициент трения поверхности ПТФЭ, способность к холодному течению и высокая пластичность этого материала при низких температурах. [15]
Страницы: 1 2