Незаполненная внешняя оболочка
Cтраница 1
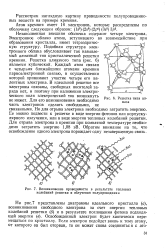 |
Решетка типа алмаза.| Возникновение проводимости в результате тепловых колебаний решетки и облучения полупроводника. [1] |
Незаполненная внешняя оболочка содержит четыре электрона. Электронное облако атома, вступившего во взаимодействие при образовании кристалла, имеет тетраэдричес-кую структуру. Подобная структура электронного облака обусловливает так называемый алмазный тип кристаллической решетки кремния. Решетка алмазного типа ( рис. 6) является кубической. Каждый атом связан с четырьмя ближайшими атомами кремния парноэлектронной связью, в осуществлении которой принимают участие четыре его валентных электрона. В идеальной решетке все электроны связаны, свободных носителей заряда нет, и поэтому при наложении электрического поля электрический ток возникнуть не может. Для его возникновения необходимо часть электронов сделать свободными, не связанными. Но для отрыва электрона необходимо затратить энергию. [2]
Незаполненная внешняя оболочка содержит четыре электрона. Электронное облако атома, вступившего во взаимодействие при образовании кристалла, имеет тетраэдрическую структуру. Подобная структура электронного облака обусловливает так называемый алмазный тип кристаллической решетки кремния. Решетка алмазного типа ( рис. 6) является кубической. Каждый атом связан с четырьмя ближайшими атомами кремния парноэлектронной связью, в осуществлении которой как раз принимают участие четыре его валентных электрона. В идеальной решетке все электроны связаны, свободных носителей заряда нет, и поэтому при наложении электрического поля электрический ток возникнуть не может. Для его возникновения необходимо часть электронов сделать свободными, не связанными. Но для отрыва электрона необходимо затратить энергию. [3]
Любой атом с незаполненной внешней оболочкой стремится вступить в связь с другими атомами, чтобы максимально заполнить ее или отдать с нее электроны. Так, атом лития с готовностью отдает свой единственный внешний электрон, удовлетворяясь заполненным К-уровнем. В то же время фтор стремится захватить недостающий электрон и заполнить L-оболочкудо магической восьмерки. А поскольку внутренний положительный заряд атома остается неизменным, литий, отдавший один электрон, становится положительно заряженным, а приобретший дополнительный электрон атом фтора приобретает отрицательный заряд. Противоположно заряженные ионы притягиваются друг к другу, образуя новое соединение - фторид лития. [4]
Элементы переходных групп и электронные конфигурации их атомов для незаполненных и внешних оболочек приведены ниже. [5]
Как со строением переходных металлов, у которых остается незаполненная предшествующая наружной ( 6d) оболочка, так и наличием незаполненной внешней оболочки у более токсичных металлов, по-видимому, можно попытаться связать их большую биологическую активность. Это может быть подтверждено тем, что многие переходные металлы - биокатали-стически важные элементы. [6]
При диссоциации атом натрия отдает атому хлора единственный электрон своей внешней оболочки и в результате становится однозарядным положительным ионом. Атом хлора имеет незаполненную внешнюю оболочку с семью электронами. Для заполнения этой оболочке недостает одного электрона, который она принимает от атома натрия и становится заполненной. Нейтральный атом хлора становится однозарядным отрицательным ионом. [7]
Атом с удаленным из / ( - оболочки электроном обычно представляет собой положительный однозарядный ион, который, однако, отличается от иона ( для элементов после гелия), образующегося при потере атомом одного валентного электрона. В редких случаях рассматриваемый / ( - электрон может ( оказаться в незаполненной внешней оболочке, и атом останется незаряженным. Если / ( - электрон выброшен из иона обычного типа ( например Na), то исходный заряд иона увеличивается на единицу. Можно говорить, что атом или ион с одиночной дыркой в / ( - оболочке находится в / ( - состоянии независимо от его заряда. [8]
Естественно ожидать, что свойства нона, плотно окруженного другими ионами противоположного заряда, должны зависеть не только от их размеров и поляризуемости, но и от структуры их внешних электронных оболочек. Необходимо различать между собой: а) ионы с заполненными 8 - и 18-злектронными оболочками, б) ионы с незаполненными внешними оболочками с двумя s - электронами ( In, TI, РЬ2), в) ионы переходных металлов с незаполненными d - оболочками. Теоретическое изучение взаимодействий ионов переходных металлов с окружающими ионами проливает свет на природу несимметричных координационных полиэдров некоторых из этих ионов. [9]
Из всего сказанного в предыдущем параграфе следует, что во время протекания некоторых органических реакций могут образовываться промежуточные частицы ( интермедиа), обладающие высокой реакционной способностью и очень коротким временем жизни. Некоторые менее известные типы промежуточных частиц перечислены в табл. 2.1. Следует отметить, что указанные промежуточные частицы могут содержать атомы с незаполненной внешней оболочкой ( например, карбокатионы); более восьми электронов на внешней оболочке содержат атомы элементов не второго, а последующих периодов. [10]
Все четыре типа связи строго не разграничены и взаимно не исключают одна другую. Тип связи может зависеть от температуры и давления. Так, германий - полупроводник при комнатной температуре является типичным представителем материала с ковалентной связью. Смешанный, ковалентно-ме-таллический тип связи возникает тогда, когда атом обладает двумя незаполненными внешними оболочками. Например, Ni и Fe имеют не до конца заполненную Зй-оболочку. Металлическую связь здесь образуют электроны внешней оболочки. [11]
Для физически разумных расстояний в паре обменные параметры практически экспоненциально падают с ростом межионного расстояния, так что обменное взаимодействие эффективно только для пар ионов, являющихся ближайшими соседями или следующими за ближайшими в зависимости от типа обмена и типа решетки. В этом смысле обменное взаимодействие является короткодействующим в отличие от дальнодействующего кулоновского взаимодействия. В частности, Декстер [342], рассматривая обменный механизм переноса энергии, полагал / - e - R / L, где R - расстояние донор - акцептор, a L - некоторая положительная константа - эффективный боровский радиус. Это приближение справедливо для больших R - причем L - 2naa / Z, где п - главное квантовое число для электронов незаполненной внешней оболочки, - эффективный заряд, в поле которого движутся электроны этой оболочки, а0 - боровский радиус. [12]
Полупроводниковые вещества, такие, как алмаз, кремний, германий, образуют кристаллы с атомной, или гомеополярной, связью. Такая связь возникает между одинаковыми или близкими по своим свойствам элементами в результате появления обменного эффекта. Обменные силы притяжения между атомами возникают в результате слияния внешних оболочек двух атомов в одну обобщенную оболочку. В такой оболочке электроны имеют спаренные спины и она более устойчива, чем две независимые орбиты. Поскольку в обменных взаимодействиях принимают участие только электроны незаполненной внешней оболочки, то атомную связь называют еще валентной или ковалентной. Она может быть такой же сильной, как и ионная связь, поэтому ионные и атомные кристаллы обладают близкими свойствами. [13]
Страницы: 1