Четвертая оболочка
Cтраница 2
Всего в четвертой оболочке имеется 30 нуклонов. Поэтому в ядре с замкнутой четвертой оболочкой содержится 50 нуклонов. [16]
Следует отметить, что, начиная от Rb и далее, суб-орбита 4 / никогда не заполняется; первый электрон входит в эту оболочку у церия. Затем от Се до Lu четвертая оболочка достраивается от 18 о 32 электронов. [17]
Из табл. 2 видно, что строгая последовательность заполнения подоболочек электронами в соответствии с последовательным уменьшением энергии связи электрона, начиная с калия, нарушается. В атомах калия и кальция заполнена первая подгруппа четвертой оболочки ( 4s), в то время как достройка последней подгруппы третьей оболочки ( 3d) не закончена. В атомах элементов, расположенных после кальция ( Sc, Ti, V и др.), имеющих во внешней оболочке по два электрона ( у хрома - 1), достраивается незаполненная 3d подгруппа М - оболочки. [18]
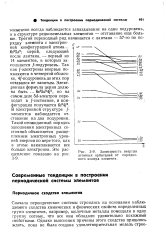 |
Зависимость энергии атомных орбиталей от порядкового номера элемента. [19] |
Третий переходный ряд начинается с лантана - 57-го по порядку элемента с электронной конфигурацией атома... Так как / - электроны впервые появляются в четвертой оболочке, 4 / - подуровень до этих пор оставался не занятым. В электронной структуре / - элементов наблюдается отставание на два подуровня. Такой неожиданный порядок заполнения электронных состояний объясняется расщеплением электронных уровней энергии по мере того, как в атоме накапливается все больше электронов. [20]
Третий переходный ряд начинается с лантана - 57-го по порядку элемента с электрон - ной конфигурацией атома... Так как / - электроны впервые появляются в четвертой оболочке, 4 / - подуровеньдоэтих пор оставался не занятым. В электронной структуре / - элементов наблюдается отставание на два подуровня. Такой неожиданный порядок заполнения электронных состояний объясняется расщеплением электронных уровней энергии по мере того, как в атоме накапливается все больше электронов. [21]
Из приведенной схемы легко видеть, что на группировку первых трех низших оболочек ( Is), ( lp), ( Id, 2s), соответствующих магическим числам 2, 8 и 20, спин-орбитальное взаимодействие фактически не влияет. При получении следующего магического числа 50 необходимо предположить, что в четвертую оболочку входят не только подоболочки ( 1 /, 2р), которые заканчиваются на 40 нуклоне, но и подоболочка Ig0 / j, содержащая 10 нуклонов, которая примыкает к четвертой оболочке. [22]
У цезия начинается постройка шестой оболочки не только до образования Sd-группы, но и на четвертой еще не начиналась постройка 4Г - группы. Заполнение этой подгруппы, находящейся глубоко внутри атома, происходит только у элементов от цезия до Кассиопея, составляющих группу редкоземельных элементов, или лантанидов, Атомы этих элементов обладают одинаковой структурой двух наружных оболочек, но различаются по степени достройки внутренней четвертой оболочки. Известно, что эти элементы по своим химическим свойствам мало различаются, так как химические свойства определяются главным образом структурой наружных электронных оболочек. То же самое повторяется в седьмом периоде периодической системы. У элементов, следующих за актинием, - актинидов происходит достройка подгруппы f пятой оболочки. [23]
Из приведенной схемы легко видеть, что на группировку первых трех низших оболочек ( Is), ( lp), ( Id, 2s), соответствующих магическим числам 2, 8 и 20, спин-орбитальное взаимодействие фактически не влияет. При получении следующего магического числа 50 необходимо предположить, что в четвертую оболочку входят не только подоболочки ( 1 /, 2р), которые заканчиваются на 40 нуклоне, но и подоболочка Ig0 / j, содержащая 10 нуклонов, которая примыкает к четвертой оболочке. [24]
Однако энергия связи электронов первых подуровней данной оболочки может быть большей, чем энергия электронов последних подуровней предыдущей оболочки. Так, первая электронная пара четвертой оболочки ( 45-электроны) обладает несколько большей энергией связи, чем электроны последнего подуровня третьей оболочки ( Зс. Поэтому 19 - й электрон атома калия и 20 - й электрон атома кальция не начинают постройки Sd-подуровня, а занимают 4-положение, так как это соответствует большей энергии связи их в атоме. Таким образом, последовательность в образовании электронами оболочек атома в этом случае нарушается. И только когда наиболее выгодный в энергетическом отношении s - подуровень четвертой оболочки достроен, следующие электроны в атомах скандия, титана, ванадия, хрома, марганца, железа, кобальта, никеля и меди окончательно достраивают третью оболочку. [25]
При увеличении числа электронов в атоме заполняются те свободные состояния, которые соответствуют наинизшей энергии. Дальше же такая простая закономерность нарушается. Например, оказывается, что первый слой четвертой оболочки соответствует меньшей энергии, чем третий слой третьей оболочки. У атома же леза ( № 26) заполнены первые две оболочки ( 10 элек тфонов), первые два слоя третьей оболочки ( 8 электро нов), в третьем же слое заполнено 6 мест из 10 вакант ных. Оставшиеся 2 электрона размещаются в первом слое четвертой оболочки. [26]
Таким образом, в электронной структуре всех трех переходных рядов элементов всегда наблюдается запаздывание на один подуровень, а в структуре редкоземельных элементов отставание еще больше. Третий переходный ряд начинается с лантана - 57-го по порядку элемента с электронной конфигурацией атома... Так как / - электроны впервые появляются в четвертой оболочке, 4 / - подуровень до этих пор оставался не занятым. [27]
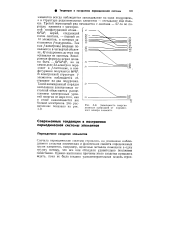 |
Зависимость энергии атомных орбиталей от порядкового номера элемента. [28] |
Третий переходный ряд начинается с лантана - 57-го по порядку элемента с электронной конфигурацией атома... Gs Sd1; церий, следующий после лантана, - первый из 14 элементов, в которых заполняется / - подуровень. Так как / - электроны впервые появляются в четвертой оболочке, 4 / - подуровень до этих пор оставался не занятым. В электронной структуре / - элементов наблюдается отставание на два подуровня. Такой неожиданный порядок заполнения электронных состояний объясняется расщеплением электронных уровней энергии по мере того, как в атоме накапливается все больше электронов. [29]
Таким образом, в электронной структуре всех трех переходных рядов элементов всегда наблюдается запаздывание на один подуровень, а в структуре редкоземельных элементов отставание еще больше. Третий переходный ряд начинается с лантана - 57-го по порядку элемента с электронной конфигурацией атома. Так как / - электроны впервые появляются в четвертой оболочке, 4 / - подуровень до этих пор оставался не занятым. Электронная формула церия должна быть. В электронной структуре / - элементов наблюдаются отставание на два подуровня. [30]
Страницы: 1 2 3