Образование - окись - углерод
Cтраница 1
Образование окиси углерода связано с неполным окислением топлива или же с диссоциацией двуокиси углерода при повышенных температурах. В США из всего количества окиси углерода, выбрасываемого в атмосферу, около 90 приходится на долю автомобилей. При запуске холодного двигателя в составе выхлопных газов содержится около 20 окиси углерода, количество которой уменьшается по мере его разогревания. При отказе от свинцового антидетонатора концентрация СО в выхлопных газах несколько снижается. [1]
Образование окиси углерода при исследовании кислородсодержащих образцов, анализируемых в масс-спектрометре, прямо пропорциональное парциальному давлению кислорода. [2]
Образование окиси углерода может итти в ряде случаев. [3]
Образованию окиси углерода по реакции ( 1) способствуют высокие температуры ( 800 - 900 С); теоретически равновесие смещается почти полностью вправо при температуре выше 900 С. [4]
Образованию окиси углерода по реакции ( 1) способствуют высокие температуры ( 800 - 900 ЭС); теоретически равновесие смещается почти полностью вправо при температуре выше 900 С. [5]
Теплота образования окиси углерода 110 5 кДж - моль 1, теплота сгорания 283 0 кДж - моль 1 ( разд. Голубоватое пламя, появляющееся над горящим древесным углем, связано с горением окиси углерода, предварительно образовавшейся при поверхностном сгорании угля. [6]
Теплота образования окиси углерода практически недоступна калориметрическому измерению, в то время как ее окисление до углекислоты, так же как прямое сгорание углерода до СО2, легко поддается измерению. Исходя из закона Гесса, можно, однако, легко вычислить теплоту образования окиси углерода. [7]
Пути образования окиси углерода неясны. [8]
Теплота образования окиси углерода ( СО) составляет 26 39, а углекислоты ( СО2) 94 03 ккал / моль. [9]
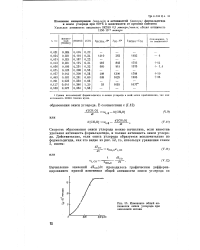 |
Изменение общей активности окиси углерода при окислении метана. [10] |
Скорость образования окиси углерода можно вычислить, если известна удельная активность формальдегида, и полная активность окиси углерода. [11]
Теплота образования окиси углерода из атомов равна 210 ккал / молъ и может быть сравнима с величиной 152 ккал / молъцля связи С0 в кетонах. [12]
Скорость образования окиси углерода можно вычислить двумя независимыми способами: во-первых, при помощи графического дифференцирования кривой накопления окиси углерода ( кривая 4); во-вторых, по удельной радиоактивности формальдегида и скорости изменения общей активности окиси углерода / со со временем. [13]
Теплоту образования окиси углерода СО из углерода и кислорода опытным путем не удается определить. [14]
Теплоту образования окиси углерода СО из углерода и кислорода непосредственным измерением ( например, в калориметре) определить не удается. [15]
Страницы: 1 2 3 4