Образование - персульфат
Cтраница 1
Образование персульфатов на электродах из окислов вольфрама. [1]
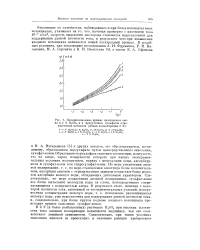 |
Поляризационные кривые платинового анода в 2 N H2SC4 и в присутствии сульфатов одновалентных металлов ( общая концентрация 2 Л. [2] |
Образование персульфата становится понятным, еслиучесть, что на аноде, заряд поверхности которого при наших экспериментальных условиях положителен, наряду с молекулами воды, адсорбируются и сульфат-ионы пли гидросульфат-ионы. Следовательно, по мере возрастания анодной поляризации, сульфат-ионы все более вытесняют молекулы воды из слоев, непосредственно соприкасающихся с поверхностью анода. [3]
При электролитическом образовании персульфатов К, МН, Л1, Nra, Mg и Zn508 было обнаружено, что присутствующие в электролите катионы различным образом влияют на процессы, протекающие на аноде и в электролите. Этим и обусловлено специфическое влияние катиона на процесс электролиза персульфатов. В табл. 22 приведены результаты опытов Есика и Алфимовой относительно влияния катиона. [4]
Известно также образование персульфата при действии перекиси водорода на сульфиты и тиосульфаты. [5]
Часть тока А расходуется на образование персульфата путем окисления ионон SO, по уравнению ( 26) или по схеме 2SOI СН - НЯО - S2o 2OH, остаток ( 1 - А) расходуется на выделение кислорода. [6]
Эти результаты позволяют считать более вероятным электронный механизм образования персульфатов. Следует, однако, указать па то, что для окончательного подтверждения этого вывода необходимо исключить другое, хотя и мало вероятное направление процесса, также согласующееся с полученными результатами-передачу атома водорода от иона HS04 - поверхности анода с последующим соединением его с адсорбированным кислородом. В настоящее время возможность такого направления реакции проверяется. [7]
При электролизе сульфатов или серной кислоты с платиновыми анодами реакции образования персульфата, элементарного кислорода и озона являются параллельными независимыми электрохимическими реакциями. [8]
Обменная реакция между очищенными от железа персульфатом аммония и хлоридом калия завершается образованием персульфата калия. В качестве побочного продукта получается хлорид аммония, обладающий высокой коррозионной активностью по отношению не только к углеродистым, но и к хромоникелевым сталям. Последние подвергаются точечной или язвенной коррозии. [9]
Это позволяет снять с обсуждения все механизмы, в которых предполагается участие кислорода воды в образовании персульфата. [10]
 |
Зависимость числа полученных молей па 1 а-ч от энергии активации. [11] |
Последние наши исследования, выполненные совместно с А. А. Петровой, подтвердив эти выводы, показали также, что наиболее успешно протекает образование персульфатов рубидия и цезия. [12]
Из этих данных видно, что оба анодных процесса - разложения Н202 и образования K2S208 - идут, по-видимому, независимо один от другого с большим преобладанием первого, если концентрация Н202 достаточно велика, так что наличие перекиси мешает образованию персульфата, что ставит под сомнение теорию промежуточного образования перекиси водорода. [13]
Позднее, в 1920 г., Книббс и Палфримен44 пришли к выводу, что обе теории не точны, и выдвинули свою собственную теорию ( видоизменение теории Эксли), по которой образование перхлората в действительности обусловлено разрядом иона С1О -, но последующая реакция аналогична реакции образования персульфата. [14]
Самое же главное - то, что скорость разложения Н2Он платиной настолько велика, что вряд ли те количества Н2О2, которые образуются на платиновом аноде, успевают окислить ионы сульфата. Таким образом, роль перекиси водорода в образовании персульфатов должна быть ничтожна. [15]
Страницы: 1 2