Образование - пироуглерод
Cтраница 2
Энергия активации процесса образования пироуглерода на поверхности сажевых частиц при атмосферном давлении составляет 66 ккал / моль. [16]
Была измерена скорость образования пироуглерода из метана и ацетилена [20] при температурах 1500 - 1900 С. Опыты проводили при относительно малой концентрации метана ( 1 - 5 объемн. Аргон нагревали в плазменной дуге и метан вводили в горячий аргон. [17]
Приняв для реакции образования пироуглерода первый порядок, Фостер выразил все результаты в виде констант скорости гетерогенной реакции и построил график в координатах Аррениуса. [18]
Энергия активации процесса образования пироуглерода, не искаженного водородным торможением и объемными реакциями, в интервале температур 750 - 900 С составляет 66 ккал / моль. Оценка энергии активации процесса при более высоких температурах но совокупности экспериментальных данных, приведенных на рис. 4.23, в частности по положению пунктирной прямой, учитывая разброс и небольшую надежность результатов, не имеет смысла. [19]
Существующее представление о механизме образования пироуглерода не имеет пока достаточного экспериментального подтверждения главным образом вследствие отсутствия необходимых данных о промежуточных продуктах пиролиза, особенно при температурах выше 1000 С. [20]
В принципе измерение скорости образования пироуглерода в слое сажи заключается в следующем. Через обогреваемую снаружи реакционную трубку ( рис. 4.1) пропускают исследуемый углеводород или смесь углеводорода с водородом или инертным газом. Температура реакционной трубки и скорость потока газа поддерживаются постоянными. В реакционную трубку на определенное время вводят лодочку с навеской сажи, удельная поверхность которой известна. Взвешивание лодочки до и после опыта дает количество углерода, образовавшегося на поверхности сажи. [21]
Для выяснения зависимости скорости образования пироуглерода от толщины образовавшегося слоя пироуглерода были поставлены опыты [35], результаты которых для канальной и ацетиленовой сажи приведены на рис. 4.22. На рисунках по оси абсцисс отложены суммарная масса навески ( в процентах от первоначальной), а по оси ординат - наблюдаемая скорость образования углерода в процентах от значения начальной скорости. На оси абсцисс вместо фактически измеряемого отношения масс отложено отношение объемов V / V0, что возможно благодаря малому различию истинной плотности первоначальных сажевых частиц и покрывающего их слоя пироуглерода. [22]
Поэтому смысл утверждения, что образование пироуглерода происходит в результате взаимодействия на поверхности молекул метана, заключается в том, что, во-первых, такой процесс возможен, или, другими словами, образование пироуглерода из метана не требует в качестве обязательной первой стадии объемного процесса, и, во-вторых, в отсутствие объемных процессов этот процесс является единственным. [23]
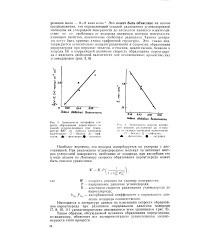 |
Зависимость энергии активации реакцнти разложения до углерода от индекса свободной валентности. [24] |
Таким образом, обсуждаемый механизм образования пироуглерода, по-видимому, объясняет все экспериментально установленные закономерности этого процесса. [25]
В результате экспериментального исследования процесса образования пироуглерода в слое сажи было доказано, что скорость образования пироуглерода прямо пропорциональна величине геометрической поверхности, находящейся в зоне реакции. [26]
Учитывая значительное влияние на скорость образования пироуглерода свойств поверхности и сравнительно низкое значение энергии активации образования пнро-углерода при термическом разложении метана, можно предположить, что элементарный акт разложения на поверхности происходит при взаимодействии молекул метана с силовым полем твердой поверхности. [27]
Как уже было сказано, для образования пироуглерода нет необходимости в протекании какого-либо предварительного объемного процесса. Однако наличие такого процесса может существенно пзменить скорость поверхностного процесса в связи с изменением состава газа, находящегося в контакте с растущей поверхностью. [28]
В-третьих, наряду с поверхностной реакцией образования пироуглерода идут различные реакции пиролиза, в результате которых образуются как более легкие, так и более тяжелые, чем исходный углеводород, молекулы и радикалы. [29]
Так как водород сильно снижает скорость образования пироуглерода, данные, полученные при применении аргона, несколько искажаются наложением влияния выделяющегося водорода на кинетику образования пироуглерода на влияние на нее строения исходного углеводорода. При разбавлении водородом это искажение устраняется. Для всех приведенных в табл. 2.2 углеводородов кроме бензола и, в меньшей степени, этилена различия в скоростях образования пироуглерода при применении в качестве разбавителя водорода очень малы. Скорость выделения пироуглерода при замене аргона на водород уменьшается в 10 - 200 раз для различных углеводородов. [30]
Страницы: 1 2 3 4 5