Образование - сероуглерод
Cтраница 2
При электротермическом способе образование сероуглерода происходит в печах шахтного типа, работающих по принципу печей сопротивления, при этом в качестве сопротивления используется или шихтовой углеродистый материал, или специальный гранулированный материал. [16]
Относительно низкая температура образования сероуглерода позволяет использовать для производства его газовые или нефтяные ретортные печи с внешним обогревом, при котором температура в стальной реторте поддерживается в пределах 800 - 900 С. [17]
Исследованию кинетики реакции образования сероуглерода из твердых углеродистых материалов и парообразной серы посвящено сравнительно небольшое число работ. До настоящего времени кинетика процесса и его механизм еще недостаточно изучены. [18]
Исходя из величин скорости образования сероуглерода по формуле Аррениуса была вычислена кажущаяся энергия активации. Оказалось, что добавка 1 9 % Na2CO3 к сахарному углю снижает энергию активации с 25 - 26 до 5 3 ккал / моль, а 2 4 % Na2CO3 к березовому углю - с 10 - 13 до 6 - 7 ккал / моль. [19]
Точных калориметрических определений теплоты образования сероуглерода из углерода и газообразной серы не имеется. [20]
Кажущаяся энергия активации процесса образования сероуглерода из древесного угля и паров серы составляет 109 кДж / моль. [21]
Расхождение в значениях теплоты образования сероуглерода объясняется различными методами ее определения. [22]
С целью углубленного изучения кинетики образования сероуглерода из древесного угля и серы была предложена новая методика, основанная на использовании радиоактивного изотопа серы s S в элементарном состоянии. [23]
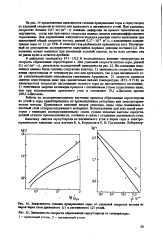 |
Зависимость степени превращения серы от удельной скорости потока ее паров через слои древесного ( / и лигнинового ( 2 углей.| Зависимость скорости образования сероуглерода от температуры. [24] |
Работы по экспериментальному изучению процесса образования сероуглерода из углей и серы ориентировались на промышленные ретортные или электротермические методы. [25]
Более подробные данные по механизму образования сероуглерода из углеводородов и серы на поверхности катализатора можно найти в работе Томаса. Предполагается, что активные участки поверхности катализатора быстро адсорбируют метан и серу. Далее происходит отщепление атома водорода и внедрение молекул серы в адсорбционный комплекс СН3 ( аде. Оставшаяся сера и водород, находящиеся также в адсорбированном виде, образуют сероводород. [26]
В почве он быстро разлагается с образованием сероуглерода и метилизотиоциа-ната. Оба продукта летучи и обладают сильным бактерицидным действием. В зависимости от метеорологических условий, типа почвы и технологии применения карбатион и продукты его трансформации удерживаются в почве 4 - 12 недель. Посев производится после этого срока, поэтому токсичное действие препарата на растениях не проявляется. [27]
Уголь сгорает в парах серы с образованием сероуглерода. Напишите уравнение этой реакции, б) Стандартная энтальпия образования CS2 ( г.) равна 115 кДж - моль-1. [28]
Исторически точность расчета термодинамических констант равновесия реакции образования сероуглерода соответствовала представлениям о молекулярном составе паров серы при различных температурах и уровню техники эксперимента того времени, когда проводилось исследование. Поэтому данные более поздних работ не согласуются с более ранними, а подчас и противоречат им, особенно в области температур, где молекулы серы диссоциированы до S, не полностью. [29]
 |
Влияние на выход продуктов размеров частиц графитовой насадки. [30] |
Страницы: 1 2 3 4