Образование - водородное соединение
Cтраница 1
Образование водородных соединений протекает с большим выделением тепла, чем кислородных, поэтому водородные соединения устойчивее кислородных. Из кислородных соединений наиболее устойчивы соли кислородных кислот и менее устойчивы окислы. [1]
 |
Содержание галогенов в земной коре. [2] |
Образование водородных соединений галогенов идет с большим выделением тепла, чем кислородных, поэтому водородные соединения устойчивее кислородных. Из кислородных соединений наиболее устойчивы соли кислородных кислот и наименее устойчивы оксиды. [3]
К тому же образование водородных соединений рассматриваемых элементов связано с диссоциацией молекул, образующих эти соединения, на атомы. [4]
В природе условия для образования водородных соединений фосфора встречаются редко, лишь там, где происходят интенсивное, без доступа воздуха, гниение органической материй, богатой фосфором: в гниющих болотах и на кладбищах. [5]
В природе условия для образования водородных соединений фосфора встречаются редко, лишь там, где происходит интенсивное, без доступа воздуха, гниение органической материи, богатой фосфором: в гниющих болотах и на кладбищах. [6]
Указанное соотношение в сильной степени проявляется в энергии образования водородных соединений галогенов, что видно из следующих термохимических данных: Н2 F2 2HF 128 ккал. [7]
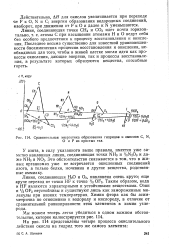 |
Сравнительная энергетика образования гидридов и окислов С, N. [8] |
Действительно, АЯ для окислов увеличивается при переходе от F к О, N и С; энергии образования водородных соединений, наоборот, при движении от F к О и далее к N уменьшаются. [9]
Бор образует ряд водородных соединений, но это не характерно для остальных элементов третьей группы; в четвертой же группе образование водородных соединений свойственно всем элементам. Однако их устойчивость в подгруппе резко падает. Так, если углерод образует огромное число водородных соединений, то для кремния их известно сравнительно немного, для германия их несколько, для олова - два, а для РЬ удалось получить только одно - РЬН4, да и оно оказалось крайне неустойчивым. Ввиду большой степени окисления элементов все водородные соединения не являются кислотами. [10]
Атомарный водород отличается способностью уже при обычной температуре восстанавливать ряд металлических окислов ( например, CuO, PbO, HgO, Ag20, Bi203), сульфиды и галогениды. С серой, мышьяком, фосфором он соединяется с образованием соответствующих водородных соединений. Последняя получается, однако, если реакция идет при низких температурах; в противном случае образуется вода. С ртутью атомарный водород реагирует с образованием устойчивого только при низких температурах твердого гидрида. Олеиновая кислота гидрируется им непосредственно ( причем частично полимеризуется), и именно так, что соединяются две молекулы кислоты, присоединяя по одному атому Н на каждую молекулу. [11]
Селен соединяется с водородом при повышенных температурах и то частично, причем теплота образования H2Se составляет 20 5 ккал. Что касается теллура, то он вообще с водородом непосредственно не соединяется. Сравнение теплот образования водородных соединений элементов группы кислорода и галогенов показывает, что первые менее активны по отношению к водороду, чем вторые. Это объясняется тем, что атомы элементов группы кислорода имеют во внешнем слое по шесть электронов, тогда как у атомов галогенов в этом слое находится по семь электронов. [12]
Например, при радиусе С1 - в 1 81 А расстояние между ядрами водорода и хлора в молекуле НС1 равно лишь 1 28 А. Водородный ион проникает, следовательно, в глубь С1 - приблизительно на треть его эффективного радиуса и только на этом расстоянии общее притяжение Н электронами С1 - оказывается компенсированным отталкивающим действием его ядра. Естественно, что подобное самопроизвольное внедрение Н в электронную оболочку аниона должно сопровождаться дополнительным ( по сравнению с другими катионами) вы - делением энергии, что и сказывается на теплотах образования водородных соединений, сильно повышая их против тех величин, которых следовало бы ожидать без учета этого обстоятельства. [13]
Представляя собой имеющий ничтожно малые размеры голый протон, ион Н в противоположность всем остальным катионам действует на имеющий свободные электроны анион не снаружи, а проникает внутрь его электронной оболочки. Например, при радиусе С1 - в 1 81 А расстояние между ядрами водорода и хлора в молекуле НС1 равно лишь 1 28 А. Водородный ион проникает, следовательно, в глубь С1 - приблизительно на треть его эффективного радиуса, и только на этом расстоянии общее притяжение Н электронами С1 - оказывается компенсированным отталкивающим действием его ядра. Естественно, что подобное самопроизвольное внедрение Н в электронную оболочку аниона должно сопровождаться дополнительным ( по сравнению с другими катионами) выделением энергии, что и сказывается на теплотах образования водородных соединений, сильно повышая их против тех величин, которых следовало бы ожидать без учета этого обстоятельства. [14]
Он образуется также, как это установил Вуд ( Wood, 1922), при пропускании тихих электрических разрядов через водород, находящийся под давлением в несколько десятых миллиметра ртутного столба. Особенно удобен для получения активного водорода способ Вуда в видоизменении Бонхофера. Атомарный водород устойчив в течение лишь очень короткого времени ( при указанном давлении приблизительно 1 / 3 - V2 сек), однако и этого срока достаточно, чтобы пропустить струю ( из разрядной трубки) над тем веществом, с которым он должен реагировать. Атомарный водород отличается способностью уже при обычной температуре восстанавливать ряд металлических окислов ( например, СиО, РЬО, HgO, AgaO, BiaOs), сульфиды и галогениды. С серой, мышьяком, фосфором он соединяется с образованием соответствующих водородных соединений. Последняя получается, однако, если реакция идет при низких температурах; в противном случае образуется вода. С ртутью атомарный водород реагирует с образованием устойчивого только при низких температурах твердого гидрида. Олеиновная кислота гидрируется им непосредственно ( причем частично полимеризуется), и именно так, что соединяются две молекулы кислоты присоединяя по одному атому Н на каждую молекулу. [15]
Страницы: 1 2