Образование - сольват
Cтраница 1
Образование сольватов сопровождается изменением оптической плотности раствора. При этом максимальной концентрации сольвато-комплексов соответствует максимальная оптическая плотность раствора. [1]
Образование сольватов отмечается и при экстракции солей LiCdJg-ЗЦГН, LiCdJg-ЗМИБК [299] и CdJs, CdJ. Сведения о взаимном расположении частиц в этих соединениях немногочисленны и противоречивы. [2]
Образование сольватов приводит к хорошо известной зависимости экстракции от концентрации экстрагента S ( описываемой множителем S. Зтот эффект не зависит от индивидуальности разбавителя. [3]
Образование сольватов ионов также зависит от полярности растворителя и концентрации раствора. Только в сильно разбавленных растворах сольватация или гидратация может считаться предельной. [4]
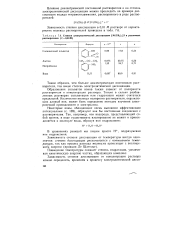 |
Степени электролитической диссоциации N ( CH3 4 ] I в различных растворителях ( С 0ОШ. [5] |
Образование сольватов ионов также зависит от полярности растворителя и концентрации раствора. Только в сильно разбавленных растворах сольватация или гидратация может считаться предельной. Количество молекул полярного растворителя, окружающих данный ион, может быть определено методом изучения электрической проводимости и электролиза. [6]
Образование сольватов ионов также зависит от полярности растворителя и концентрации раствора. Только в сильно разбавленных растворах сольватация или гидратация может считаться предельной. Количество молекул полярного растворителя, окружающих данных ион, может быть определено методом изучения электропроводности и электролиза. [7]
Образование сольватов различного состава предполагается и при экстракции рения спиртами и кетонами. [8]
Поскольку образование сольватов сопровождается изменением внутренней энергии, методы определения количества молекул низ-комолекулярнои жидкости, удерживаемых молекулами полимеров ( так называемый связанный растворитель), должны быть основаны на измерении физических величин, непосредственно зависящих от энергии взаимодействия между молекулами. Такими величинами является теплота набухания, диэлектрическая про1гицаег мость раствора, его сжимаемость. [9]
Поскольку образование сольватов сопровождается изменением внутренней энергии, методы определения количества молекул низ-комолекулярнои жидкости, удерживаемых молекулами полимеров ( так называемый связанный растворитель), должны быть основаны на измерении физических величин, непосредственно зависящих от энергии взаимодействия между молекулами. Такими вели - лшами является геплога набухания, диэлектрическая проггицаег мость раствора, его сжимаемость. [10]
Поскольку образование сольватов сопровождается изменением внутренней энергии, методы определения количества молекул низ-комолекулярнои жидкости, удерживаемых молекулами полимеров ( так называемый связанный растворитель), должны быть основаны па измерении физических величин, непосредственно зависящих от энергии взаимодействия между молекулами. Такими величинами является геплога набухания, диэлектрическая про. [11]
На образование сольвата влияет не только длина углеводородной цепочки, но и ее строение. Обнаружено [2, 18], что и растворимость, и экстракционная способность изо-эфиров с разветвленной цепочкой заметно ослаблены по сравнению с растворимостью и экстракционной способностью нормальных эфиров. [12]
Возможность образования сольвата при указанных концентрациях кислоты объясняет не только факт отклонения реальной кривой концентрации кислоты от теоретически возможной, но и другие явления, перечисленные выше. [13]
Процесс образования сольватов называется сольватацией. Процесс образования гидратов называется гидратацией. [14]
К образованию сольватов или ассоциатов способны вещества, для которых характерно сичытое межмолекулприое взаимодействие В молекулах таких жидкостей имеются сильнополярные группы или группы, образующие водородные связи Эти жидкости в изолированном состоянии склони к ассоциации. В растворах образование сольватов или ассоциатов эаиисит от строения молекул обоих компонентов Одна и та же жидкость А в жидкости В ассоциируется, а в жидкости С может образовывать сольватьт. Это зависит от соотношения полярностей жидкостей. Сильнополярная жидкость А в 1енолярнь Х жидкостях склонна к ас-сациапии, так как молекулы А взаимодействуют чруг с другом При смешении полярных жидкостей близких по полярности обычно наблюдается сольватация. [15]
Страницы: 1 2 3 4