Образование - тиосульфат
Cтраница 3
Согласно патентам, используя этот процесс, можно снизить образование тиосульфата и тем самым снизить расход соды. В качестве поглотителя сероводорода используются не растворы солей мышьяковой кислоты, а арсенит и арсенат. Процесс состоит из четырех ступеней. На первой ступени воздух, содержащий сероводород, вступает в контакт с раствором мышьяковистой кислоты. [31]
В присутствии большой концентрация сульфата в растворе наблюдается снижение образования тиосульфата. При концентрации сульфата натрия 0 3 г / л образуется 20 - 25 мг / л тиосульфата, что составляет 16 - 20 % от всего поглощенного сероводорода. [32]
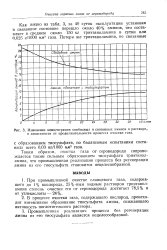 |
Изменение концентрации свободных и связанных аминов в растворе, в зависимости от продолжительности процесса очистки газа. [33] |
Таким образом, очистка газа от сероводорода сопровождается таким сильным образованием тиосульфата триэтаноламина, что промышленная реализация процесса без регенерации амина из его тиосульфата становится нецелесообразной. [34]
При наличии в газе кислорода сероводород реагирует с моноэтаноламином с образованием тиосульфата моноэтаноламина166, накопление которого приводит к снижению абсорбционной емкости растворителя. [35]
Поглотительный раствор стабилен, за исключением незначительного расхода щелочи за счет образования тиосульфата; регенерация всех компонентов поглотителя достигается в ходе процесса. [36]
Растворение серы в теплом растворе сульфита щелочного металла M2S03 приводит к образованию тиосульфата. [37]
Они растворимы в воде, спирте и быстро окисляются на воздухе с образованием тиосульфата цезия и солей тионового ряда. [38]
Подробными исследованиями установлено, что значительная часть серы не выделяется в свободном виде, а расходуется на образование тиосульфата, политионатов и тиокислот. Невозможность влиять на протекание этих реакций, интенсивная коррозия аппаратуры, а также небольшая скорость основной реакции привели к тому, что работы по этому процессу практически не ведутся. [39]
 |
Физические свойства жидких полисульфидных полимеров. [40] |
Сульфит натрия применяют для удаления подвижной серы из концевых тиомеркаптидных групп, образующихся на промежуточной стадии при реакции образования тиосульфата. Одновременно разрываются три-сульфидные и полисульфидные группы и образуются более стабильные дисульфидные связи. [41]
Из реакции ( 5) видно, что хотя рассматриваемый способ называется сульфидным, фактически в новых аппаратурных условиях образование тиосульфата идет, как в сульфгидратном способе. В этом способе образование тиосульфата натрия происходит в благоприятных условиях, создаваемых бисульфитом и сульфпидратом натрия. Механизм образования тиосульфата атрия становится понятным из схемы взаимодействия сульфгидрата с ( бисульфитом. [42]
Из реакции ( б) видно, что хотя рассматриваемый способ называется сульфидным, фактически в новых аппаратурных условиях образование тиосульфата идет, как в сульфгидратном способе. В этом способе образование тиосульфата натрия происходит в благоприятных условиях, создаваемых бисульфитом и сульфоидратом натрия. Механизм образования тиосульфата атрия становится понятным из схемы взаимодействия сульфгидрата с ( бисульфитом. [43]
Тетра - и пентатионаты взаимодействуют с сульфидами щелочных металлов ( тритионаты при комнатной температуре практически не реагируют) с образованием тиосульфата, который определяют иодометричееки. Избыток сульфида из смеси удаляют обработкой суспензией карбоната кадмия. [44]
Наряду с основными реакциями, протекающими в процессе поглощения и регенерации, в результате которых образуется элементарная сера, проходят побочные реакции образования тиосульфата и роданида натрия. Последний образуется при наличии цианистого водорода в очищаемом газе. [45]
Страницы: 1 2 3 4