Образование - трехокись - азот
Cтраница 1
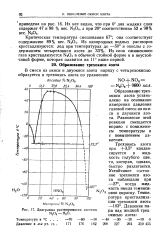 |
Диаграмма растворимости системы N2O3 - Н2О. [1] |
Образование трехокиси азота установлено на основании измерения давления газовой смеси из окиси и двуокиси азота. Равновесие этой реакции смещается вправо с понижением температуры и с повышением давления. [2]
Образование трехокиси азота установлено на основании измерений давления газовой смеси, окиси и двуокиси азота. Равновесие реакции смещается вправо с понижением температуры и повышением давления. [3]
Образование трехокиси азота МОз допускается некоторыми авторами. [4]
Имеются указания, что равновесие реакции образования трехокиси азота устанавливается за 0 1 сек. [5]
Увеличение давления и понижение температуры способствует образованию трехокиси азота. Эта реакция протекает также с большой скоростью. [6]
Во всех этих уравнениях не учитывается сокращение объема газа вследствие образования трехокиси азота в том случае, когда в нитрозных газах присутствуют окись и двуокись азота. Это вполне допустимо, если исходить из малой концентрации окислов азота. [7]
Во всех этих уравнениях не учитывается уменьшение объема газа вследствие образования трехокиси азота в том случае, когда в нитрозных газах присутствуют окись и двуокись азота. Это вполне допустимо, если исходить из малой концентрации окислов азота. [8]
Во всех этих уравнениях не учитывается сокращение объема газа вследствие образования трехокиси азота в том случае, когда в нитрозных газах присутствуют окись и двуокись азота. Это вполне допустимо, если исходить из малой концентрации окислов азота. [9]
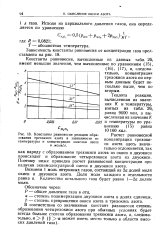 |
Константы равновесия реакции образования трехокиси азота в зависимости от температуры и концентрации окислов азота в моль. л. [10] |
Расчет равновесной концентрации трехокиси азота здесь значительно осложняется, так как наряду с образованием трехокиси азота из окиси и двуокиси происходит и образование четырехокиси азота из двуокиси. Поэтому ниже приведен расчет равновесной концентрации при наличии эквимолекулярной смеси и двуокиси азота. [11]
Интересно отметить, что в присутствии катализатора ( 2 % стеарата свинца) скорость образования трехокиси азота увеличивалась. [12]
Эти определения позволяли исключить из числа катализаторов вещества, увеличивающие скорость реакции путем создания совершенно нового равновесного состояния, которое не может быть достигнуто в отсутствие добавленного вещества. При комнатной температуре пятиокись азота медленно разлагается по сложному механизму с образованием нестабильной промежуточной трехокиси азота; медленной стадией является получение окиси азота и кислорода из трехокиси азота - реакция, в которой некоторое участие принимает двуокись азота. [13]
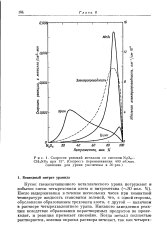 |
Скорости реакций металлов со смесями N204. [14] |
Кусок свежезачищенного металлического урана погружают в избыток смеси четырехокиси азота и нитрометана ( - 30 мол. После выдерживания в течение нескольких часов при комнатной температуре жидкость становится зеленой, что, с одной стороны, обусловлено образованием трехокиси азота, с другой - наличием в растворе четырехвалентного урана. Никакого замедления реакции вследствие образования нерастворимых продуктов не происходит, и реакция протекает спокойно. [15]
Страницы: 1