Образование - уровни
Cтраница 1
 |
Зонная схема адсорбента ( Евак - уровень энергии электронов в вакууме. [1] |
Образование уровней Шокли на поверхности возможно при определенных параметрах решетки. Если постоянная решетки меньше некоторой величины, то поверхностные состояния отсутствуют. Кроме того, поверхностные состояния не образуются в ионных кристаллах. В большинстве окисных полупроводников и в диэлектриках, используемых в катализе, связь Me-О в значительной степени ионная ( Me - металл), вследствие чего наличие у них поверхностных уровней Шокли и Тамма маловероятно. Таким образом, в зонной модели любое твердое тело представляется в основном тремя зонами электронных состояний: валентной зоной, которая при температуре, близкой к 0 К, полностью заполнена, зоной проводимости, все уровни которой при 0 К не заполнены, и запрещенной зоной, разделяющей валентную зону и зону проводимости ( рис. IX.1) Наличие дефектов кристаллической структуры или присутствие примесных атомов вызывает появление локальных разрешенных уровней электронов, расположенных внутри запрещенной зоны. Для различных адсорбентов возможны разные варианты расположения локальных уровней в запрещенной зоне. На рис. IX.1 заполненный локальный уровень изображен со стрелками, незаполненный - пунктиром. [2]
Присутствие двуокиси углерода в фунтовой воде способствует образованию уровней с почти нейтральным рН, при котором часть разряженного атомарного водорода проникает в сталь, локально разрушая ее таким образом, что трещины зарождаются и растут вследствие комбинации растворения и водородного охрупчивания. [3]
На рис. 68 приведена заимствованная из [1451, 1473] схема образования уровней энергии - молекулярных орбит для октаэдри-ческих цианокомплексов металлов. [4]
В действительности имеются два механизма экситонной люминесценции у дефектов кристаллов. Во-первых, дефекты приводят к образованию местных уровней возбуждения, которые лежат ниже, чем уровни свободного экситона. Перенос энергии к дефекту приводит к захватыванию ее и последующему испусканию, о чем уже говорилось. Во-вторых, имеется механизм, по которому свободные экситоны преобразуются в фотоны без сопутствующей этому процессу локализации электронной энергии возбуждения. Для того чтобы понять, как это происходит, надо четко представлять, что схема, в которой экситоны и фотоны рассматриваются как совершенно независимые разделенные категории, исключая момент поглощения или испускания, является только приближением. Учет запаздывания, которое возникает из-за конечной скорости распространения взаимодействия ( скорость света), приводит к смещению экситонов и фотонов и появлению того, что он называет поляритонами. Дефекты кристалла оказывают возмущающее действие на поляритоны, приводя, по-видимому, к усилению их фотоноподобного характера и тем самым к испусканию. Численные оценки относительной скорости этих двух процессов, выполненные для антрацена при 20 К, показывают, что более предпочтительной является вторая, нелокализованная модель, для которой скорость больше на порядок или даже выше. [5]
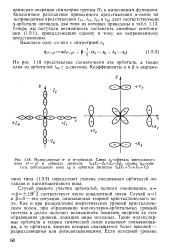 |
Молекулярные а - и я-орбитали. Слева ег-орбиталь центрального. [6] |
Как и при расщеплении энергетических уровней кристаллическим полем, при образовании молекулярно-орбитальных уровней система в целом получает возможность понизить энергию за счет образования уровней, лежащих ниже исходных. Такие молекулярные орбитали в теории химической связи называют связывающими, а те орбитали, энергия которых оказывается более высокой - разрыхляющими или антисвязывающими. [7]
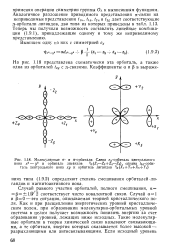 |
Молекулярные а - и я-орбитали. Слева ег-орбиталь центрального. [8] |
Как и при расщеплении энергетических уровней кристаллическим полем, при образовании молекулярно-орбитальных уровней система в целом получает возможность понизить энергию за счет образования уровней, лежащих ниже исходных. Такие молекулярные орбитали в теории химической связи называют связывающими, а те орбитали, энергия которых оказывается более высокой - разрыхляющими или антисвязывающими. [9]
Контакт с кожей может вызвать раздражение. Наибольшей промышленной опасностью химических веществ является вдыхание работниками их паров, в связи с тем, что давление паров чаще всего достаточно высоко для образования значительных уровней содержания паров в воздухе рабочих помещений. При воздействии высоких температур, огня или механического удара некоторые алифатические нитросоединения вызывают опасности, связанные с возгоранием и взрывами. Также могут происходить спонтанные экзотермические химические реакции. Симптомы поражения могут включать в себя следующее: раздражение слизистой оболочки, тошноту, рвоту, головные боли, одышку и головокружение. Постоянное воздействие данных веществ может повысить риск возникновения онкозаболеваний ( у животных), ишемической сердечной болезни и внезапной смерти. [10]
Критическое расстояние Rc, найденное для случая тушения люминесценции европия ионами неодима, оказалось равным 12 8 А. Тушение типа В обусловлено прежде всего зарядовыми дефектами. Для случая примесей молибдена или вольфрама тушение связано также с образованием уровней захвата, которые отчетливо проявляются в спектрах термостимулированной люминесценции. После переноса энергии возбуждения Mo-центрам в них происходит безызлучательная диссипация энергии или свето-запасание. Слабые или нулевые эффекты тушения для тушителей типа С обусловлены отсутствием у них уровней энергии, сильно взаимодействующих с европием, а также с отсутствием зарядовых дефектов. [11]
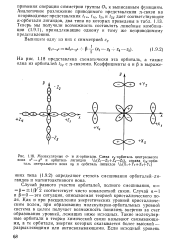 |
Молекулярные а - и я-орбитали. Слева ег-орбиталь центрального иона х2 - у2 и орбиталь лигандов lh ( Z - Z2 Z4 - Z5, справа таль центрального иона ху и орбиталь лигандов. [12] |
Случай равного участия орбиталей, полного смешивания, а Р 1 / К2 соответствует чисто ковалентной связи. Как и при расщеплении энергетических уровней кристаллическим полем, при образовании молекулярно-орбитальных уровней система в целом получает возможность понизить энергию за счет образования уровней, лежащих ниже исходных. Такие молекулярные орбитали в теории химической связи называют связывающими, а те орбитали, энергия которых оказывается более высокой - разрыхляющими или антисвязывающими. [13]
Случай равного участия орбиталей, полного смешивания, а Р 1 / К2 соответствует чисто ковалентной связи. Как и при расщеплении энергетических уровней кристаллическим полем, при образовании молекулярно-орбитальных уровней система в целом получает возможность понизить энергию за счет образования уровней, лежащих ниже исходных. Такие молекулярные орбитали в теории химической связи называют связывающими, а те орбитали, энергия которых оказывается более высокой - разрыхляющими или антисвязывающими. [14]
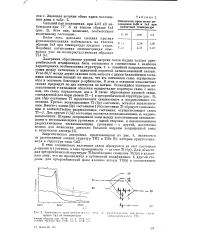 |
Зависимость края полосы погло-щешш InJ от температуры. [15] |
Страницы: 1 2