Бидерманн
Cтраница 1
Бидерманн и Силлен [11] представили исторический обзор работ по контролю коэффициентов активности в водных растворах с помощью постоянной ионной среды; при этом измерения обычно выполнялись в присутствии избытка электролита, который, как обычно предполагается, не образует комплексов с А или В. В литературе сообщалось, что Бодлендер использовал постоянную ионную среду, но, по-видимому, первой опубликованной работой такого рода явилось сообщение Гроссмана [41] в 1905 г. Гроссман изучил реакции между ртутью ( II) и тиоци-анат-ионом в растворах, которые содержали также нитрат-ионы и ионы калия в таких количествах, чтобы поддерживать постоянную общую концентрацию ионов калия. Бьеррум наблюдал, что константа гидролиза изменяется с изменением общей концентрации ионов хрома в растворах, которые не содержат нейтрального электролита, но остается почти постоянной в 0 1 М растворах хлорида калия. [1]
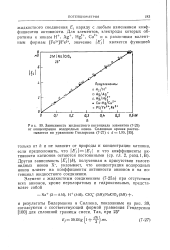 |
Зависимость жидкостного потенциала элементов ( 7 - 25 от концентрации водородных ионов. Сплошная кривая рассчитывается по уравнению Гендерсона ( 7 - 27 с d 1 95, . [2] |
Бидерманна и Силлена, показанные на рис. 39, согласуются с соответствующей формой уравнения Гендерсона [100] для сплошной границы смеси. [3]
Вилер, Бинни и фирма Imperial Chemical Industries [20], а также Руддер и Бидерманн [21] взяли патенты на добавление к газообразным углеводородам хлора и водорода. Углеводороды разлагаются под действием. Преимущество этого способа выражается также и в разбавлении газовой смеси, причем образующийся хлористый водород может быть удален легче всякого другого разбавителя промыванием водой. [4]
Особенно заметные по величине фй возникают на границе соприкосновения растворов, у которых значительно различаются концентрации ионов водорода, обладающие, как известно, большой подвижностью. Бидерманну и Л. Г. Силлену [4], на границе 3 М КаС1О4 с раствором ( 3 - h) M NaClO4 h М НС1О4 при Л 0 6, Фй8 мв, причем между h и фй при / г 0 6 наблюдается линейная зависимость. [5]
Для него баланс начинался не с актива, а с пассива, и именно пассив рассматривался как центральный его разрез. Все факты хозяйственной жизни Бидерманн сгруппировал по ходу движения капитала на четыре множества, каждое из которых должно было соответствовать одной из четырех фаз кругооборота: ( 1) финансирование - факты, которые связаны с отражением источников получения, обеспечивающих хозяйственную деятельность предприятия; ( 2) ангажирование - факты, связанные с превращением денежных средств в материальные ценности; ( 3) реализация - факты, отражающие превращение материальных ценностей в денежную массу: ( 4) адаптация - самофинансирование, т.е. возвращение капитала в первоначальную форму, результат реформации. [6]
При изучении сложных равновесий желательно поэтому попытаться контролировать коэффициенты активности путем использования буфер -, ного электролита, строго идентифицировать комплексы и определять стехиометрические константы устойчивости, относящиеся к конкретным солевым средам. Использование солевых сред для контроля коэффициентов активности было описано в обзоре Бидерманна и Силлена [28], но этот метод часто понимается неправильно. Коэффициенты активности считаются зависящими только от ионной силы ц в очень разбавленных растворах ( 0 1-моляльных), так что очень прочные комплексы можно исследовать в растворах, сильно отличающихся по составу, если ионная сила невелика и постоянна. [7]
Природа и концентрация фоновой соли определяют те влияния на коэффициенты активности, которые вызываются изменениями, имеющими место в исследуемой среде. Известно довольно мало работ по коэффициентам активности форм с низкой концентрацией в растворе, содержащем два или более фоновых электролита, и, кроме того, исследования смешанных электролитов [51, 99], по-видимому, ограничиваются применением водных растворов. Бидерманн и Силлен [ И ] изучили поведение водородного окислительно-восстановительного и металлического электродов в средах с концентрацией ЗМ по перхлорат-иону, которые содержали переменные количества водородных и натриевых ионов и низкие постоянные концентрации исследуемого катиона ( см. гл. [8]
Величины F, F и F обычно зависят от природы катионов Na и Н в фоновом электролите. В простейшем случае, который развит Гуггенгеймом [42], F и F имеют постоянные значения, равные 0 5, и F равно нулю. Однако имеется еще слишком мало данных, чтобы соотношения такого типа можно было считать достаточным объяснением результатов, полученных Бидерманном и Силленом для многовалентных катионов. [9]
Страницы: 1