Окисел - марганец
Cтраница 2
Устойчивый при комнатной температура а-маргаиец, содержащий обычные загрязнения, имеет в из ломе несколько красноватый О ттекок, какой наблюдается на кристаллах висмута. Оттенок этот получается вследствие почти мгновенного образования тонкого слоя окисла марганца на поверхности иелома. На воздухе такой марганец сравнительно быстро покрывается постепенно все более и более толстым слоем окисла и, наконец, становится совершенно черным. Такое окисление марганец обнаруживает лишь в том случае, если он содержит определенное количество примесей. При полном отсутствии их, как укавывалосъ выше, марганец сохраняется блестящим в течение неопределенно долгого времени. [16]
При описанном способе окисления главным продуктом является кристаллическая кислота, а нейтральное вещество получается в сравнительно малом количестве, но ведя эеакцию окисления другим образом, можно получить значительные выходы этого последнего, как видно из следующего опыта: 5 гр. Горячая жидкость была отфильтрована от окисла марганца и дала при охлаждении обильную кристаллизацию среднего продукта. [17]
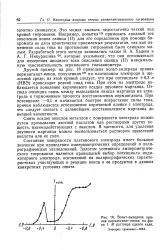 |
Вольт-амперная кривая перманганат-ионов на фоне 1 М раствора едкого кали. [18] |
Другой пример: на рис. 18 приведена вольт-амперная кривая перманганат-ионов, полученнаяш на платиновом электроде в щелочной среде; из этой кривой следует, что при потенциале 0 3 в ( НВЭ) происходит резкий спад тока. При этом на электроде наблюдается появление коричневого осадка двуокиси марганца. Отсюда очевидна связь между выделением окисла марганца на электроде и торможением процесса восстановления перманганата. При потенциале - 0 1 в начинается быстрое возрастание силы тока, причем наблюдается исчезновение коричневой пленки с электрода, что следует связать с дальнейшим. [19]
Другой пример: на рис. 18 приведена вольт-амперная кривая перманганат-ионов, полученная129 на платиновом электроде в щелочной среде; из этой кривой следует, что при потенциале 0 3 в ( НВЭ) происходит резкий спад тока. При этом на электроде наблюдается появление коричневого осадка двуокиси марганца. Отсюда очевидна связь между выделением окисла марганца на электроде и торможением процесса восстановления перманганата. При потенциале - 0 1 в начинается быстрое возрастание силы тока, причем наблюдается исчезновение коричневой пленки с электрода, что следует связать с дальнейшим восстановлением марганца до низшей валентности. [20]
Сказанное выше легко иллюстрировать на примере марганца и его различных степеней окисления. Марганец с кислородом образует пять окислов, обладающих различными свойствами. Изменения степени окисления марганца от 2 до 7 сопровождается усилением кислотных и ослаблением основных свойств окислов Закись марганца МпО - основной окисел; окись марганца Мп2О3 также проявляет основные свойства; двуокись марганца МпО2 - наиболее устойчивый при обычных условиях окисел марганца, обладающий амфотерными свойствами; марганцовистый ангидрид МпО3 ( в свободном виде не получен) и марганцевый ангидрид Мп2О7 являются кислотными окислами. [21]
При этой технологии ( табл. 2 - 42) покрытие изготавливается из суспензии металлического порошка ( или смеси порошков) в биндере. Порошки могут состоять только из металлов, ыераетворяющихся или мало растворяющихся в соединительных сплавах ( разд. Применяемыми при этом металлами являются молибден, вольфрам, марганец, железо, хром, медь, никель, рений. К металлическим порошкам иногда добавляют небольшое количество окислов ( например, окисел марганца), чтобы облегчить процесс окисления, необходимый для образования соединения. [22]
Сказанное выше легко иллюстрировать на примере марганца и его различных степеней окисления. Марганец с кислородом образует пять окислов, обладающих различными свойствами. Изменения степени окисления марганца от 2 до 7 сопровождается усилением кислотных и ослаблением основных свойств окислов. Закись марганца МпО - основной окисел; окись марганца Мп2О3 также проявляет основные свойства; двуокись марганца МпО2 - наиболее устойчивый при обычных условиях окисел марганца, обладающий амфотерными свойствами; марганцовистый ангидрид МпО3 ( в свободном виде не получен) и марганцевый ангидрид Мп2О7 являются кислотными окислами. [23]
Вторая проблема, представляющая интерес для катализа, относится к нанесеннь м перманганатным катализаторам. На рис. 26 показаны спектры двух таких катализаторов. Рентгенографическим способом не найдено доказательств содержания в них кристаллических фаз. Состав перманганата на силикагеле, по-видимому, остается без изменений. Перманганат на активированном угле восстанавливается, как это видно из спектра, до МпО2 или до какого-то другого водного окисла марганца. [24]
Вторая проблема, представляющая интерес для катализа, относится к нанесенным перманганатным катализаторам. На рис. 26 показаны спектры двух таких катализаторов. Оба катализатора были получены пропиткой водным раствором NaMnCh. Рентгенографическим способом не найдено доказательств содержания в них кристаллических фаз. Состав перманганата на силикагеле, по-видимому, остается без изменений. Перманганат на активированном угле восстанавливается, как это видно из спектра, до МпО2 или до какого-то другого водного окисла марганца. [25]
Страницы: 1 2