Окисление - магний
Cтраница 2
Отсюда следует, что окисление магния входящими в состав воды атомами водорода в степени окисления - f - 1 возможно, и реакция будет протекать в прямом направлении. [16]
Отсюда следует, что окисление магния водой в этих условиях возможно, а обратная реакция окисления водорода оксидом магния невозможна. [17]
Интересно отметить, что скорость окисления магния во влажном кислороде, как установил Терем [669], вдвое меньше, чем в атмосфере воздуха. Это можно приписать образованию гидроокиси, обладающей большим объемным отношением по сравнению с окисью магния MgO, хотя Гиббс и Свек не называют гидроокись магния среди продуктов окисления под действием водяного пара. [18]
Из этих уравнений следует, что окисление магния - это процесс отдачи его атомом валентных электронов атому окислителя, в данном случае кислорода, который восстанавливается и переходит в отрицательный ион. [19]
Из этих уравнений следует, что окисление магния - это процесс оттягивания от его атома двух валентных электронов атомом окислителя, в данном случае кислорода, который восстанавливается, принимая при этом отрицательную степень окисления. [20]
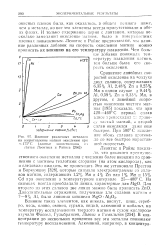
Проведенные расчеты показывают, что при окислении магния сплошной пленки окислов образоваться не может, поэтому зависимость коррозия - время будет выражаться прямой ( рис. 3, а), а скорость коррозии по - стоянна во времени. Процессы коррозии, для которых характерен начальный индукционный период ( рис. 3 0), обнаруживают увеличение скорости коррозии во времени. Это может быть связано с наличием первичной защитной пленки, которая при взаимодействии со средой некоторое время защищает металл, а затем разрушается. Более сложные зависимости ( рис. 3, г и д) наблюдаются при периодическом разрушении пленок продуктов коррозии, что может быть вызвано ростом в них внутренних напряжений сжатия. [21]
Одним из важных вопросов для понимания механизма окисления магния, на котором до сих пор не было заострено внимание, является упругость пара металла. Упругость пара увеличивается с повышением температуры и может быть причиной растрескивания пленки окиси магния. [22]
Некоторое снижение выхода по току обусловлено еще окислением магния, плавающего на поверхности. Хотя металл и защищен от действия воздуха пленкой электролита и окиси магния, но все же иногда наблюдаются вспышки его, особенно если температура ванны высока. [23]
При нагреве порошка магния в парах воды идет реакция окисления магния, сопровождающаяся большим тепловым эффектом. [24]
Поэтому и указанную реакцию следует рассматривать так же, как окисление магния. [25]
 |
Влияние различных металлов. [26] |
И только содержание церия с лантаном, которые несколько замедляют окисление магния, было в поверхностных пленках повышенным. Леонтнс и Райнс предполагают, что влияние различных добавок на скорость окисления магния можно приписать их влиянию на его температуру плавления. [27]
Здесь хлор является окислителем, а взаимодействие магния с хлором-реакцией окисления магния; атомы хлора, оттягивая электроны от атома магния, восстанавливаются, принимая отрицательную степень окисления. [28]
Образующаяся на металлическом магнии защитная пленка MgO плохо растворима в воде, поэтому окисление магния идет сравнительно медленно. Гидрат окиси бария, кроме того, понижая растворимость гидрата окиси магния, препятствует дальнейшему окислению магния. [29]
Избирательное окисление ( выжигание) магния в алюминиевом сплаве теоретически возможно, поскольку свободная энергия окисления магния больше, чем у алюминия. Однако, практически это ведет к значительному угару алюминия. [30]
Страницы: 1 2 3 4