Окисление - щелочной металл
Cтраница 1
Окисление щелочных металлов серой идет также очень энергично; при растирании металла с серным цветом происходит взрыв. [1]
Окисление щелочных металлов серой идет очень энергично: при растирании металла с серным цветом происходит взрыв. Состав продуктов, образующихся при взаимодействии щелочных металлов с серой зависит от исходного соотношения реагентов. [2]
При окислении щелочных металлов образуются соединения которым прежде приписывали формулу R2O4 и название четырех окисей. [3]
Таким образом, представляется возможность использовать не енолизирующиеся кетоны для окисления щелочных металлов с целью получения их перекисей и над-перекисей. По мнению некоторых исследователей [123], эта гладко протекающая в мягких условиях реакция может представлять определенный интерес прикладного характера. [4]
Такой путь определения этих величин является наиболее целесообразным, поскольку при окислении щелочных металлов кислородом образуется смесь окислов различного состава, которую точно проанализировать весьма трудно. [5]
Это означает, что скорость реакции не зависит от времени. Окисление щелочных металлов и алюминия ( при повышенных температурах) происходит по этому закону. Возникающие окисные пленки являются не сплошными, а пористыми. [6]
Щелочные металлы взаимодействуют и со многими другими простыми веществами, такими как F2, С12, Вг2, I2, S, N2, P, С, Si и др. Все эти вещества ведут себя по отношению к щелочным металлам как окислители. Продуктами окисления щелочных металлов галогенами являются соли соответствующих галогено-водородных кислот. [7]
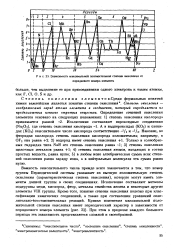 |
Зависимость максимальной положительной степени окисления от порядкового номера элемента. [8] |
Степень окисления - воображаемый заряд атома элемента в соединении, который определяется из предположения ионною строения вещества. Только в солеобраз-ных гидридах типа NaH его степень окисления равна - 1; 3) степень окисления щелочных металлов равна 1; 4) степень окисления атомов, входящих в состав простых веществ, равна нулю; 5) в любом ионе алгебраическая сумма всех степеней окисления равна заряду иона, а в нейтральных молекулах эта сумма равна нулю. [9]
Степень окисления - воображаемый заряд атома элемента в соединении, который определяется из предположения ионного строения вещества. Только в солеобраз-ных гидридах типа NaH его степень окисления равна - 1; 3) степень окисления щелочных металлов равна 1; 4) степень окисления атомов, входящих в состав простых веществ, равна нулю; 5) в любом ионе алгебраическая сумма всех степеней окисления равна заряду иона, а в нейтральных молекулах эта сумма равна нулю. [10]
Для кинетики взаимодействия металлов с газообразным кислородом существенное значение имеет соотношение между атомным объемом металла и молекулярным объемом образующегося из него окисла. В том случае, когда последний близок к первому или больше его, как это имеет место, например, при окислении железа или алюминия, в результате окисления часто образуется сплошной слой окисла, в той или другой мере обладающий защитными свойствами. Вследствие уменьшения объема атома, обусловленного переходом в ионное состояние, увеличение объема металла при его окислении происходит не всегда; например, оно не происходит при окислении щелочных металлов. В этом случае не получается сплошных слоев окисла, и окисление может идти беспрепятственно до конца, по крайней мере при не слишком низких температурах. [11]
Тройной сплав для синтеза ТЭС должен содержать - 9 % натрия и 0 5 - 1 0 % калия. Сплав используется в виде гранул неправильной формы, размер 1 - 5 мм. Снаружи гранулы серые, в изломе серебристые. На воздухе сплав склонен к самовоспламенению за счет активного окисления щелочных металлов. [12]
 |
Орбитальные и эффективные радиусы некоторых атомов и ионов. [13] |
Степень окисления эле м е нтов. Степень окисления, - воображаемый заряд атома элемента в соединении, который определяется из Предположения ионного строения вещества. Только в соле-образных гидридах типа NaH его степень окисления равна - 1; 3) степень окисления щелочных металлов равна 1; 4) степень окисления атомов, входящих в состав простых веществ, равна нулю; 5) в любом ионе алгебраическая сумма всех степеней окисления равна заряду иона, а в нейтральных молекулах эта сумма равна нулю. [14]
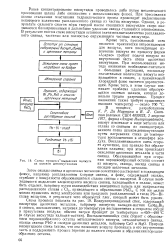 |
Схема процесса выделения висмута из шлаков девисмутизации. [15] |
Страницы: 1 2