Окисление - молекула
Cтраница 1
Окисление молекул гидроксиламина во внутренней сфере двухвалентной платины всегда сопровождается одновременным замещением на хлорогруппу адденда, находящегося в транс-положении к гидроксиламину. [1]
Окисление юдной молекулы за счет другой молекулы того же самого вещества - явление, весьма часто встречающееся в химии. Он о всегда сопровождается потерей свободной энергии, кото-рой первоначально обладает система. Вся энергия, которой обладает какая-либо система, состоит частью из свободной, частью из связанной энергии. Самопроизвольно протекающая реакция характеризуется тем, что свободная энергия системы по завершении реакции меньше той, которой обладала система до реакции. Состояние с наименьшим запасом свободной энергии является наиболее устойчивым. [2]
КЗ окисление молекулы глюкозы надо затратить 12 атомов кислорода, что отвечает отдаче 24 электронов. [3]
При окислении молекулы спирта идет гидроксилирование того углерода, при котором стоит первая гидроксильная группа. Получается неустойчивое соединение с двумя гидроксилами у одного углерода, из которого выделяется молекула воды и образуется карбонильная группа. [4]
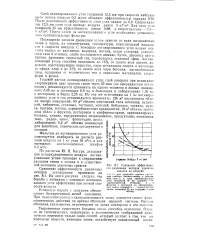 |
Сравнение эффективности различных методов удаления запахов из воздуха. [5] |
При окислении молекул пахнущих веществ запах лишается своего физиологического действия на органы обоняния нервной системы Органы обоняния, как известно, не реагируют на запах кислорода и его окислов. [6]
Должно происходить окисление молекул воды. [7]
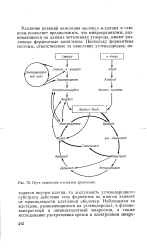 |
Пути окисления к-алканов дрожжами. [8] |
Различие реакций окисления молекул м-алкана и глюкозы позволяет предположить, что микроорганизмы, развивающиеся на данных источниках углерода, имеют различные ферментные комплексы. [9]
Непосредственным результатом окисления молекулы ацетона является образование уксусной кислоты и свободных метильных радикалов; последние окисляются в НСООН и СО. Одновременно без затраты электричества происходит реакция димеризации радикалов с образованием этана. Такое представление о механизме процесса хорошо объясняет наблюдающиеся на опыте закономерности. [10]
Весь процесс окисления молекулы глюкозы ( в виде гликогена) образует 40 высокоэргических связей, содержащих 460 ккал, которые могут потребляться в синтезах. Следовательно, в окислительном процессе вырабатывается несравненно больше энергии, чем в анаэробном процессе. [11]
Взаимодействие сопровождается окислением молекул воды и выделением кислорода. [12]
Если восстановление или окисление молекулы в определенном месте может привести к образованию различных продуктов, то при подыскании соответствующего метода следует руководствоваться тем, какого рода восстановление ли окисление является в данном конкретном случае - желательным. [13]
На аноде идет окисление молекул воды с выделением кислорода. [14]
Хотя большинство методов окисления частично защищенных молекул углеводов приводит лишь к незначительным успехам, окисление воздухом или кислородом в присутствии катализаторов из редких металлов [54] проходит довольно удовлетворительно. [15]
Страницы: 1 2 3 4